
 Muchos aspectos de nuestra vida se relacionan con la química, desde los alimentos que consumimos, los medicamentos, las prendas de vestir y los combustibles hasta los procesos que ocurren en nuestro organismo, como la digestión y la respiración. Los químicos han creado nuevos materiales o maquinarias que ayudan al ser humano a mejorar sus condiciones de vida. La química estudia la composición, estructura y propiedades de la materia, así como sus transformaciones. Es una ciencia antigua que ha evolucionado a lo largo del tiempo; por ejemplo, en el siglo XIX, los científicos lograron separar las sustancias en sus componentes y conocer sus características físicas y químicas. En el siglo XX, gracias al desarrollo tecnológico, se logró entender la estructura de átomos y moléculas; esto permitió diseñar nuevas sustancias indispensables, como fármacos y productos de consumo no contaminantes.
Muchos aspectos de nuestra vida se relacionan con la química, desde los alimentos que consumimos, los medicamentos, las prendas de vestir y los combustibles hasta los procesos que ocurren en nuestro organismo, como la digestión y la respiración. Los químicos han creado nuevos materiales o maquinarias que ayudan al ser humano a mejorar sus condiciones de vida. La química estudia la composición, estructura y propiedades de la materia, así como sus transformaciones. Es una ciencia antigua que ha evolucionado a lo largo del tiempo; por ejemplo, en el siglo XIX, los científicos lograron separar las sustancias en sus componentes y conocer sus características físicas y químicas. En el siglo XX, gracias al desarrollo tecnológico, se logró entender la estructura de átomos y moléculas; esto permitió diseñar nuevas sustancias indispensables, como fármacos y productos de consumo no contaminantes.

Configuración química de los elementos
 La química es el estudio de la materia y los cambios que ocurren en ella (Chang, 2020). Los conocimientos de la química se relacionan con la biología, física, geología, ecología y muchas otras disciplinas. Es parte importante de la cotidianidad, ya que permite el desarrollo de automóviles, electricidad, computadoras y otros objetos que hacen más cómoda la vida.
La química es el estudio de la materia y los cambios que ocurren en ella (Chang, 2020). Los conocimientos de la química se relacionan con la biología, física, geología, ecología y muchas otras disciplinas. Es parte importante de la cotidianidad, ya que permite el desarrollo de automóviles, electricidad, computadoras y otros objetos que hacen más cómoda la vida.
La materia es todo aquello que ocupa espacio, tiene masa y posee inercia (Chang, 2020). En términos generales, la materia es todo aquello que se puede ver y tocar; además, se divide en sustancias puras y mezclas. Las primeras son una forma de materia con una composición y propiedades distintivas, ya que sus componentes no pueden separarse por métodos físicos, como la evaporación, destilación, decantación o tamizado. Las sustancias puras se clasifican en elementos y compuestos.
 Un elemento es un tipo de sustancia pura, formada por átomos de la misma clase, que no se separan en sustancias más simples por medios químicos. Se han identificado 118 elementos, la mayoría con un origen natural y otros obtenidos artificialmente, es decir, mediante procesos nucleares. Para identificarlos y representarlos, se usan símbolos químicos conformados por una o dos letras; cabe señalar que la primera siempre aparece en mayúscula. Por ejemplo, el símbolo químico del oxígeno es O; sin embargo, cuando se utilizan dos letras, como en el caso del litio, la primera es mayúscula y la segunda minúscula: Li.
Un elemento es un tipo de sustancia pura, formada por átomos de la misma clase, que no se separan en sustancias más simples por medios químicos. Se han identificado 118 elementos, la mayoría con un origen natural y otros obtenidos artificialmente, es decir, mediante procesos nucleares. Para identificarlos y representarlos, se usan símbolos químicos conformados por una o dos letras; cabe señalar que la primera siempre aparece en mayúscula. Por ejemplo, el símbolo químico del oxígeno es O; sin embargo, cuando se utilizan dos letras, como en el caso del litio, la primera es mayúscula y la segunda minúscula: Li. 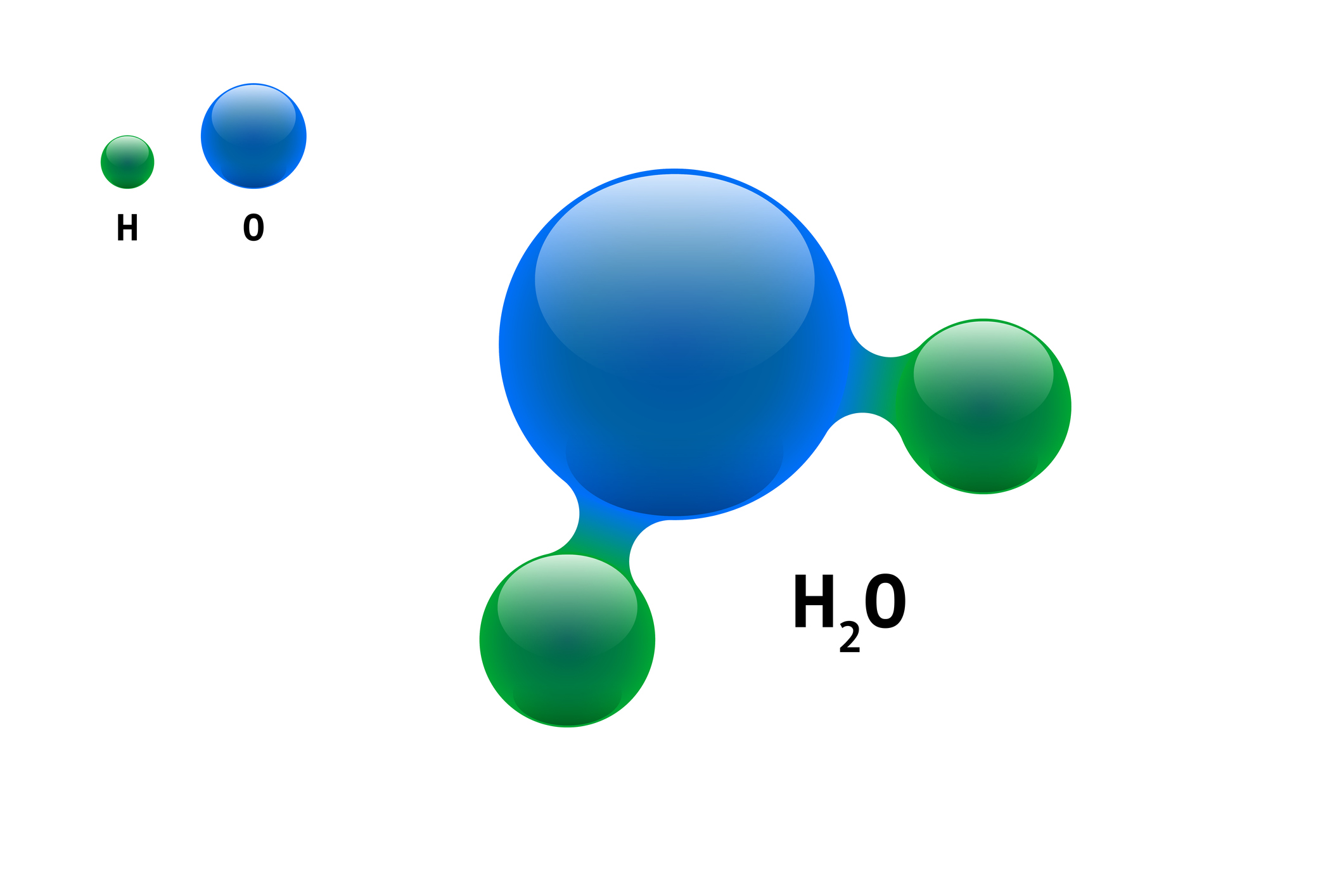
Por otro lado, una mezcla es una combinación de sustancias, cada una con sus propiedades distintivas, las cuales pueden separarse por procesos físicos, como el tamizado, la destilación, la decantación, entre otros. En términos generales, las mezclas se clasifican en homogéneas y heterogéneas:
El filósofo griego Demócrito fue el primero en proponer que toda la materia estaba conformada por partículas pequeñas e invisibles que no se pueden dividir, a las que llamó átomo. Siglos después, Dalton definió al átomo como una “unidad básica de un elemento que puede intervenir en una combinación química” (Chang, 2020). En el siglo XX, se demostró que los átomos están formados por piezas aún más pequeñas. Estas partículas subatómicas poseen determinadas cargas eléctricas y se clasifican de esta manera:
Las partículas con cargas eléctricas distintas (positiva y negativa) se atraen, mientras que las del mismo tipo se repelen. Los átomos se identifican por el número de neutrones y protones en su núcleo; de hecho, la cantidad de protones determina el número atómico (Z) de un elemento. En un átomo neutro, entonces, protones y electrones se igualan en número.
La masa atómica equivale al total de partículas en el núcleo, es decir, a la suma de protones y neutrones; sin embargo, esta medición varía entre los átomos de un mismo elemento, ya que el número de neutrones puede cambiar de uno a otro; por tanto, la masa atómica (A) de un elemento puede cambiar, incluso cuando su número atómico se mantenga constante. A estas variaciones se les denomina isótopos y un elemento puede llegar a poseer dos o más de ellos (Chang, 2020).
En la tabla periódica, los elementos se encuentran organizados de acuerdo con las semejanzas en sus propiedades químicas y físicas, ya que se acomodan a partir de su número atómico (Z). Los elementos se organizan en filas llamadas periodos y en columnas denominadas grupos o familias; aquellos que pertenecen al mismo grupo cuentan con características semejantes. Además, según sus propiedades, los elementos se clasifican en metales, no metales y metaloides.
En la naturaleza, los átomos generalmente no se encuentran aislados, pues se unen a otros y forman moléculas. Estas se estructuran a partir de átomos del mismo o de distintos elementos (Chang, 2020).
Los iones son partículas, ya sea de átomos o moléculas, con una carga eléctrica determinada, es decir, no pueden resultar neutras. Aquellos que poseen una carga negativa se conocen como aniones, mientras que los que cuentan con una positiva se denominan cationes.
Cambios de estado de la materia
La materia presenta diferentes propiedades, algunas físicas y otras químicas. Las primeras se corresponden con las características del objeto, es decir, se pueden medir y observar, sin alterar la composición de la sustancia; por ejemplo, el color, la temperatura y la dureza. A su vez, las propiedades físicas se clasifican en dos tipos:
Por su parte, las propiedades químicas se pueden observar solo cuando la sustancia sufre alguna alteración o cambio en su estructura interna, ya que esto permite su transformación (Chang, 2020).
Es muy importante comprender que los estados de agregación de la materia son las faces o etapas que presenta una sustancia, las cuales dependen de las fuerzas de unión entre las partículas que la forman. Los estados se clasifican en sólido, líquido y gaseoso.
La materia puede sufrir cambios físicos o químicos. Los primeros no afectan la naturaleza de la materia, aunque sí modifican su aspecto, y se producen por la acción de un agente externo, como la energía. A continuación, se mencionan los diferentes cambios de estado físico:
Un cambio químico ocurre cuando la sustancia original se combina con otras para convertirse en un producto nuevo.

A lo largo de este tema, conociste la importancia de la química en el estudio de la estructura y composición de la materia; además, exploraste los diferentes niveles de una sustancia, desde el átomo, la partícula más pequeña, hasta las moléculas y mezclas. Asimismo, reconociste la diferencia entre cambios físicos y químicos de la materia.

Asegúrate de:

