
 La materia sufre distintos cambios, tanto físicos como químicos. Los cambios químicos generan nuevas sustancias a partir de las originales y, por ese motivo, a dichas modificaciones se les conoce como reacciones químicas. A lo largo de este tema, comprenderás cómo ocurren, cuáles son sus componentes y, finalmente, cuántos tipos de reacciones químicas existen.
La materia sufre distintos cambios, tanto físicos como químicos. Los cambios químicos generan nuevas sustancias a partir de las originales y, por ese motivo, a dichas modificaciones se les conoce como reacciones químicas. A lo largo de este tema, comprenderás cómo ocurren, cuáles son sus componentes y, finalmente, cuántos tipos de reacciones químicas existen.

Ecuaciones químicas
La unión de dos o más átomos forma una molécula, la cual se estructura de partículas de diferentes elementos que, a su vez, forman un compuesto. Cuando ocurre esto, los átomos pierden o ganan electrones hasta que obtienen ocho en su orbital más externo (electrones de valencia), ya que así cumplen con la regla del octeto (Chang, 2020).
De acuerdo con Chang (2020), las fuerzas de atracción, que mantienen unidos a los átomos en las moléculas y a los iones en los cristales, se llaman enlaces químicos. Existen tres tipos de enlace: iónico, covalente y metálico.
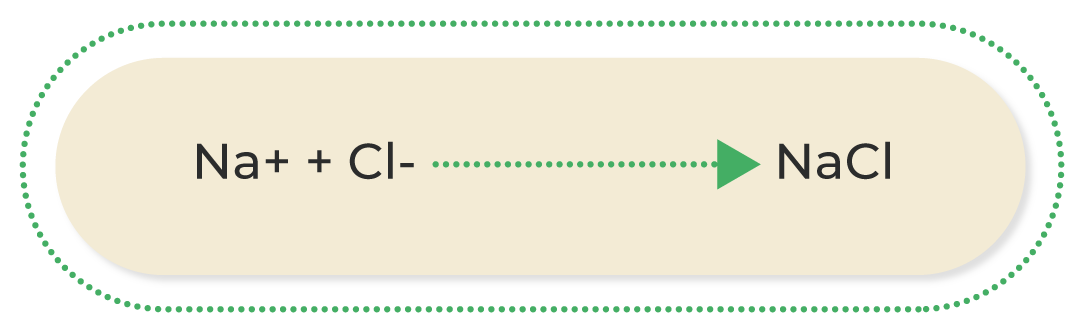
El enlace iónico se da cuando uno de los átomos capta los electrones del otro, es decir, uno los gana y el otro los pierde. Los compuestos iónicos se caracterizan por la unión de un metal con un no metal; por ejemplo, la unión del ion cloruro (Cl) con el ion sodio (Na) produce cloruro de sodio (NaCl):
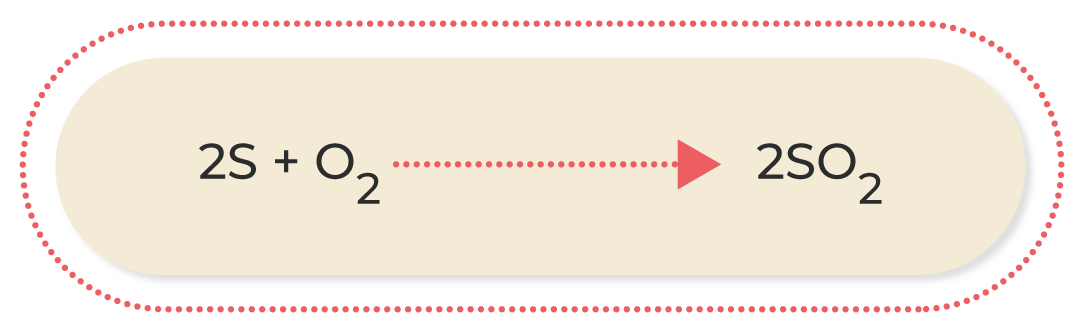
El enlace covalente se establece entre dos átomos que comparten electrones del último nivel para alcanzar una configuración más estable; en este caso, con ocho electrones en su última capa. En este enlace, ambos átomos pueden compartir uno, dos o tres pares de electrones, formando un enlace simple, doble o triple. Por ejemplo, en la unión del oxígeno (O) con el azufre (S) para formar monóxido de azufre (SO), ambos elementos comparten un par de electrones.
El enlace metálico se encarga de unir los átomos de los metales y, además, les proporciona sus propiedades físicas más conocidas, como dureza, brillo y la capacidad de conducir electricidad o calor. Las aleaciones son un buen ejemplo de enlace metálico, como ocurre con la unión de cobre (Cu) y estaño (Sn) para formar bronce (Chang, 2020).
Cuando átomos o moléculas adquieren una carga eléctrica se les denomina ion; si están formados por una sola unidad, se conocen como iones monoatómicos. Cuando pierden electrones, los metales forman iones positivos llamados cationes; en estos casos, los nombres de los iones positivos se forman a partir del elemento del que proviene, anteponiendo la palabra ion; por su parte, los no metales ganan electrones, así que forman iones negativos conocidos como aniones (Chang, 2020).
Ahora bien, una reacción química es un proceso donde una o más sustancias, llamadas reactivos, se transforman en otras muy diferentes, denominadas productos. Para saber si se está produciendo una reacción química, deben observarse las siguientes evidencias:
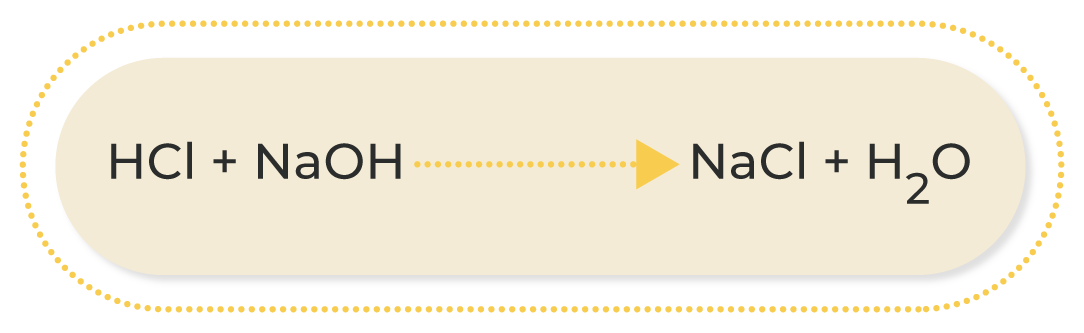
De acuerdo con Chang (2020), “una ecuación química es una descripción simbólica de una reacción química”. Las fórmulas de los reactivos se escriben a la izquierda, seguidas por una flecha; por su parte, las fórmulas de los productos se escriben a la derecha:

En determinados casos, las fórmulas en una ecuación pueden incluir letras, las cuales se colocan entre paréntesis e indican el estado físico de las sustancias, como sólido (s), líquido (l) y gaseoso (g).
Tipos de reacciones
Las reacciones químicas con pérdida o ganancia de calor se clasifican en dos tipos: exotérmicas o endotérmicas. La primera ocurre cuando emana o se desprende energía durante la reacción; por su parte, la segunda sucede cuando se requiere agregar energía, ya sea por medio de calor, radiación, electricidad, etcétera (Chang, 2020).
Algunas sustancias químicas cambian la velocidad de una reacción y se les conoce como catalizadores; por ejemplo, las enzimas del cuerpo humano que ayudan al metabolismo.
La mayor parte de las reacciones químicas se llevan a cabo cuando las sustancias están disueltas en agua. De hecho, existen tres tipos de reacciones en solución acuosa: precipitación, ácido-base y óxido-reducción o redox (Chang, 2020).
De acuerdo con Chang (2020), “la oxidación se define como la pérdida de electrones; mientras que la reducción es la ganancia de electrones”. Por regla general, los átomos de un metal pierden electrones, es decir, se oxidan; en cambio, los átomos de un no metal tienden a ganar electrones, por tanto, se reducen. En una reacción redox, un agente reductor proporciona electrones y un agente oxidante los acepta. El número de oxidación equivale a la cifra de electrones ganados, perdidos o prestados durante una reacción.
Las reacciones más comunes de oxidación-reducción son las siguientes:
A continuación, podrás observar una breve explicación de los diferentes tipos de reacciones de oxidación-reducción:
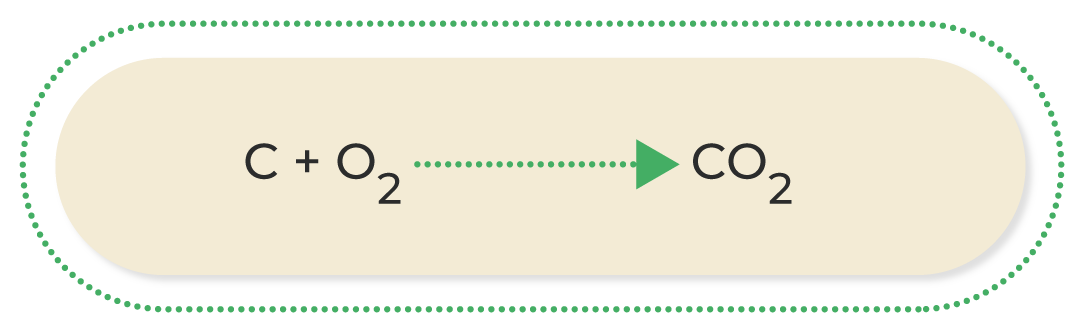
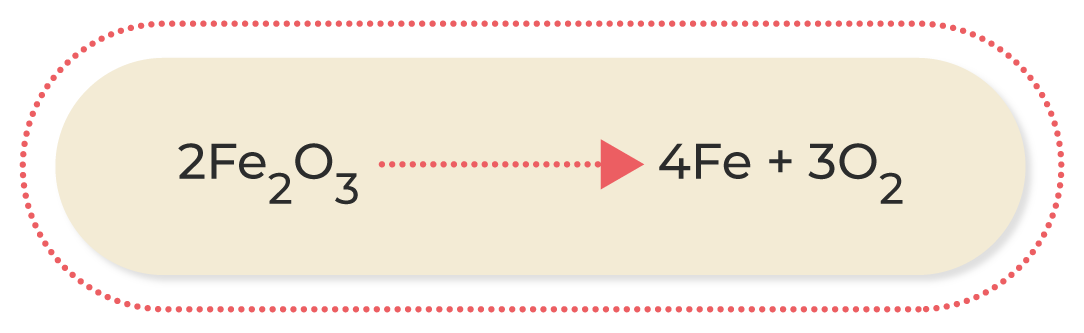
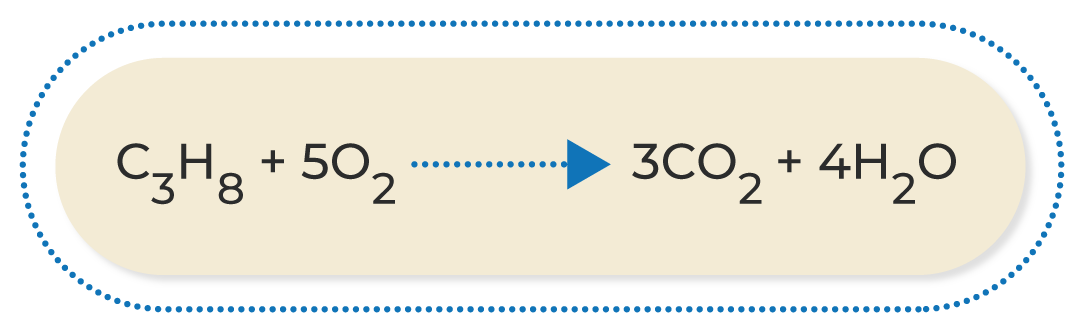
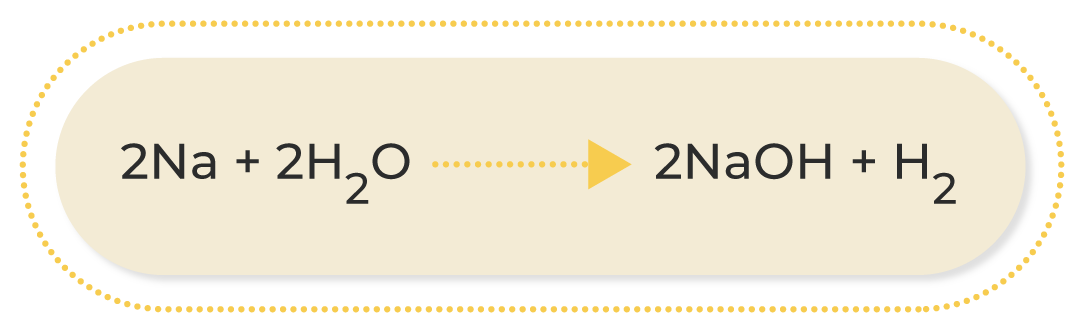
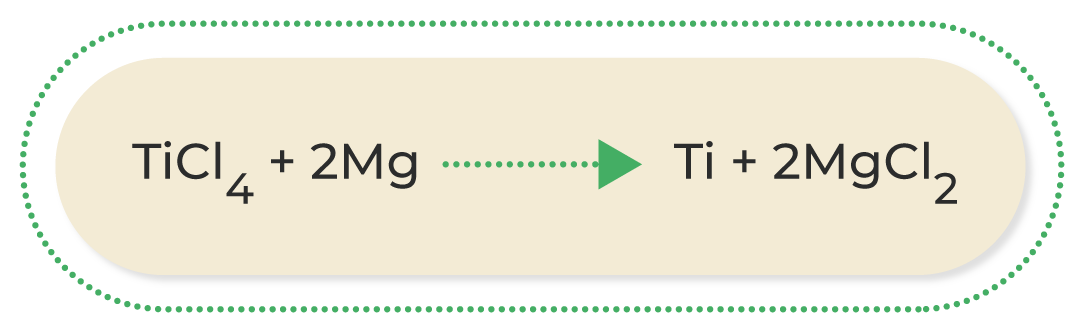
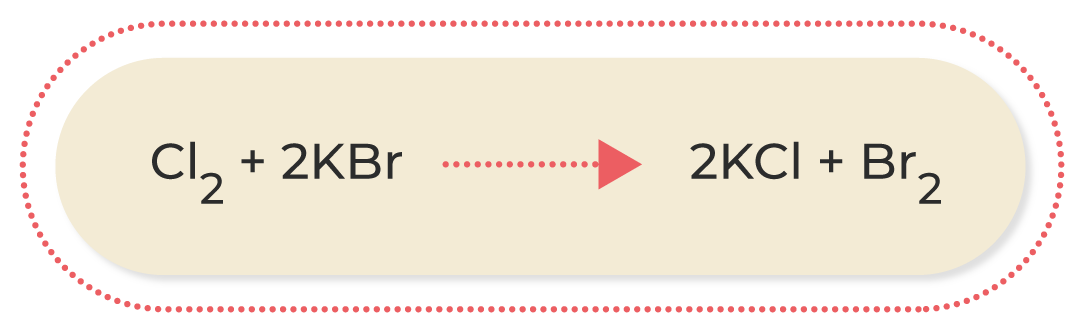
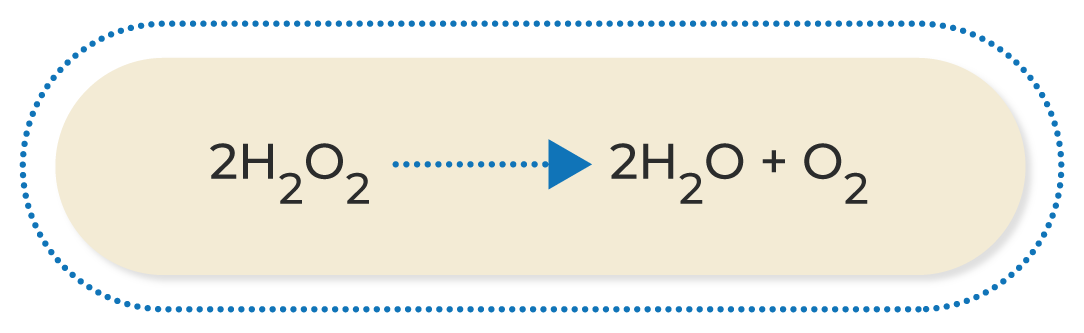

Al conocer las ecuaciones químicas, se puede identificar lo que ocurre durante una reacción química; por este motivo, es muy importante familiarizarse con los diferentes compuestos que participan en ella. Asimismo, conocer las características de los diferentes tipos de reacciones químicas permite deducir los productos que se obtendrán cuando termine; esto ayuda a estimar los procesos necesarios para conseguir una sustancia determinada.

Asegúrate de:

