
 Las reacciones químicas están involucradas en gran parte de las actividades industriales; por ejemplo, en la producción de medicamentos, alcohol, pinturas, alimentos, plásticos, fertilizantes, entre otros más. Para estos sectores, es muy importante conocer la cantidad de materia prima que deben utilizar para obtener la mayor cantidad de producto. La estequiometria es la rama de la química que permite realizar esos cálculos; además, gracias a ella, se obtiene información de la eficiencia en los procesos.
Las reacciones químicas están involucradas en gran parte de las actividades industriales; por ejemplo, en la producción de medicamentos, alcohol, pinturas, alimentos, plásticos, fertilizantes, entre otros más. Para estos sectores, es muy importante conocer la cantidad de materia prima que deben utilizar para obtener la mayor cantidad de producto. La estequiometria es la rama de la química que permite realizar esos cálculos; además, gracias a ella, se obtiene información de la eficiencia en los procesos.

Cálculo de materia
Debido a su pequeño tamaño, átomos y moléculas no se pueden pesar directamente; por tanto, se requiere de una enorme cantidad de estos para obtener una porción suficiente que se pueda medir. En química, se usa una unidad de medición llamada mol, la cual determina la cantidad de una sustancia en cierta porción de unidades elementales (átomos, moléculas u otras partículas). El mol contiene 6.022 × 1023 elementos y, a dicha cifra, se le conoce como número de Avogadro (NA) (Chang, 2020).
La masa molar (M) es la cantidad de materia, expresada en gramos o kilogramos, que hay en un mol de unidades de una sustancia, ya sean átomos o moléculas. La masa de las moléculas se calcula al sumar las masas atómicas de los átomos que la conforman; para realizar este cálculo, hay que multiplicar la masa atómica de cada elemento por el número de átomos de ese elemento en la molécula y, al final, sumar todos los resultados.
Ejemplo. Calcula la masa molar de la molécula de agua H2O.
1. Se obtiene la masa atómica de cada uno de los elementos:
2. Se multiplica su masa atómica por el número de moles de cada elemento:
![]()
![]()
3. Se suman los resultados: ![]()
4. Por tanto,18g/mol es la masa molar del agua (H2O).
Antes de calcular las cantidades de reactivos y productos que intervienen en una reacción, se necesita que la ecuación esté balanceada; es decir, debe contar con la misma cantidad de átomos de cada elemento en ambos lados.
De acuerdo con Chang (2020), el procedimiento para balancear una ecuación química se da de la siguiente forma:
Por ejemplo, balancea la siguiente ecuación:
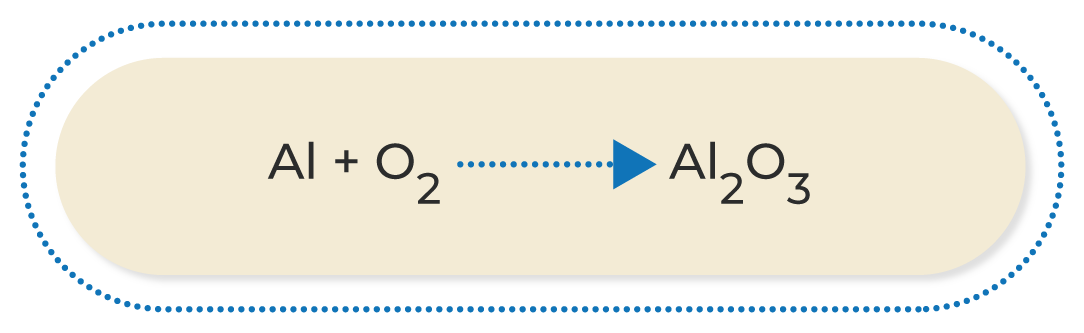
Los dos átomos aparecen una sola vez en ambos extremos de la ecuación, pero los dos elementos tienen diferente número a cada lado. En este caso, considera que el oxígeno tiene dos átomos en los reactivos y tres en los productos; para igualarlo, se intercambian los subíndices como coeficiente en la molécula del otro lado de la ecuación:
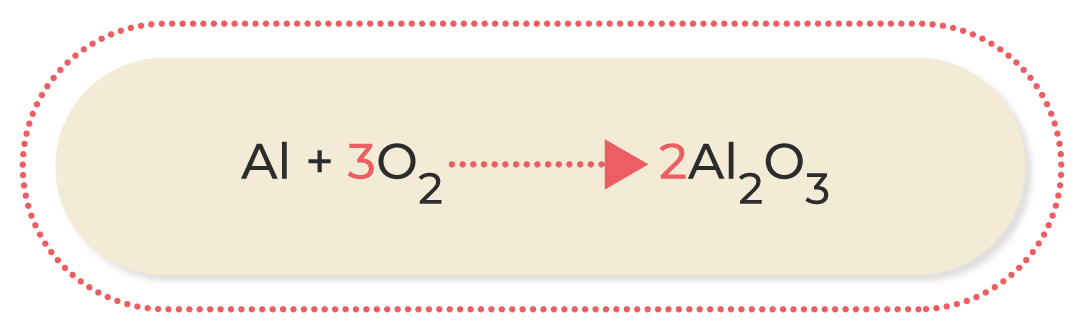
Por último, se balancea el aluminio, agregando cuatro al coeficiente en la parte de los reactivos:
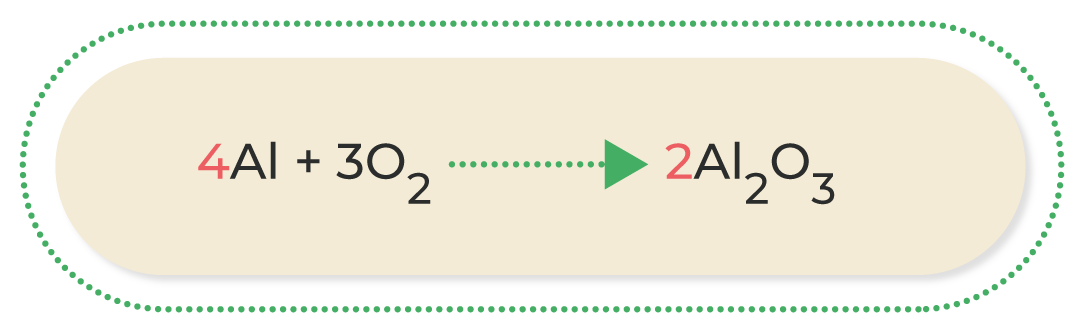
Por último, se verifica que la ecuación esté balanceada:
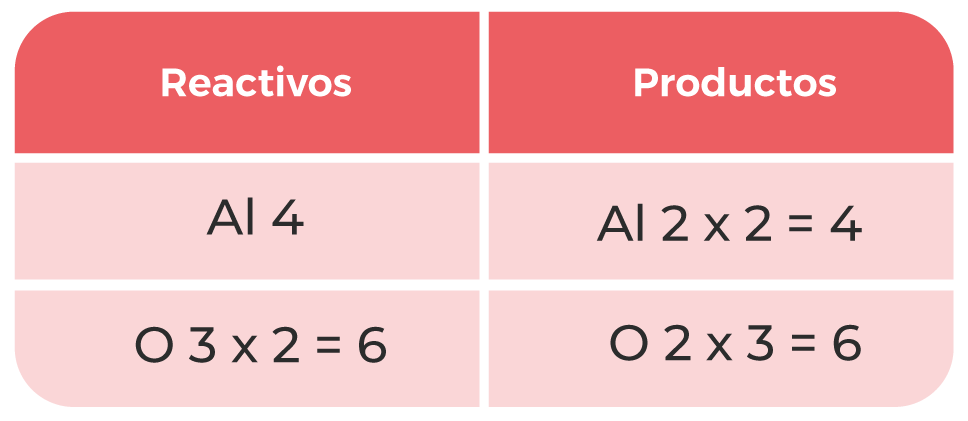
Tabla 1. Comparación de átomos entre reactivos y productos.
En la industria química, es importante utilizar las porciones correctas de reactivos para obtener la mayor cantidad de productos.
La estequiometría se encarga de proporcionar estos cálculos; con ella, se verifica que la cantidad de reactivos sea la misma que de productos (Chang, 2020). Esta disciplina se basa en la ley de la conservación de la materia, la cual tiene varias implicaciones; por ejemplo, el número total de átomos de cada elemento permanece igual antes y después de la reacción.
Según Chang (2020), el siguiente método sirve para solucionar problemas de estequiometría:
Por ejemplo, si 16.0 g de H2 (hidrógeno) reaccionan con N2 (nitrógeno) para formar NH3 (amoniaco), ¿cuántos gramos de NH3 se formarán?
1. Convertir 16.0 g de H2 a moles:
![]()
= 7.94 mol H2
2. Calcular el número de moles de NH3 producido:
![]()
= 5.29 mol NH3
3. Finalmente, determinar la masa de NH3 en gramos:
![]()
= 90.1g NH3
Cálculo de reactivo limitante y rendimiento
Por lo general, una reacción química se detiene porque se acaba uno de los reactivos. A este se le conoce como reactivo limitante, mientras que al sobrante se le llama reactivo en exceso.
La porción de reactivo limitante determina la cantidad de producto que se obtendrá al finalizar la reacción. A la cantidad de producto conseguida, calculada a partir de la ecuación balanceada, se le llama rendimiento teórico. En la práctica, la cantidad de producto generada en una reacción suele resultar menor que la estimada mediante el rendimiento teórico y, por este motivo, se le denomina rendimiento real (Chang, 2020).
Al conocer los rendimientos real y teórico de un producto, se puede expresar la producción real como rendimiento porcentual.
![]()

En la vida diaria, se generan numerosos procesos, ya sea en la industria, agricultura, ganadería o incluso en la cocina, donde se necesita determinar las cantidades de sustancias que se usarán para obtener un producto esperado. Emplear la proporción correcta de reactivos disminuye los costos de producción y hace más eficiente los procesos.

Asegúrate de:

