
Tipos, porcentaje, partes por millón y molaridad de soluciones
Solución química
Se conoce como solución o disolución al conjunto de dos o más sustancias puras que forman una mezcla homogénea. Esta combinación no se considera una reacción química, ya que puede encontrarse en una única fase sólida, líquida o gaseosa, independientemente de que sus componentes por separado se encuentren en otro estado; por ejemplo, al disolver agua (líquida) con sal (sólida), el resultado será agua salada, es decir, ambos componentes en estado líquido. Toda solución química está conformada por, al menos, dos componentes: el soluto (que se disolvió) y el solvente (que disolvió) (Chang, 2020).
- Características de las soluciones químicas
- En general, toda sustancia está compuesta por un solvente y un soluto; estos no se pueden separar por métodos físicos, como la filtración, ya que sus componentes generan interacciones químicas muy fuertes.
- Toda solución química posee un soluto y un solvente, los cuales se pueden detectar con algún procedimiento.
- Forman una solución homogénea, es decir, sus componentes no se pueden distinguir a simple vista.
- Sus componentes solo se pueden separar mediante un método químico, como destilación, cristalización o cromatografía.
Tipos de soluciones químicas
 Las soluciones químicas se pueden clasificar por medio de dos criterios: el soluto y el disolvente.
Las soluciones químicas se pueden clasificar por medio de dos criterios: el soluto y el disolvente.
- Diluidas. Cuando la cantidad del soluto es mínima en comparación con el solvente; por ejemplo, un litro de agua (solvente) con un gramo de café (soluto).
- Concentradas. Cuando la solución del soluto es considerable en comparación con el solvente; por ejemplo, un litro de agua (solvente) con 25 gramos de café (soluto).
- Saturadas. Cuando el solvente no soporta más cantidad de soluto a una temperatura determinada; por ejemplo, un litro de agua (solvente) con 50 gramos de café (soluto) a 25° centígrados.
- Sobresaturada. Cuando la cantidad de soluto puede aumentar si se incrementa la temperatura en soluciones saturadas, ya que se fuerza al solvente a aceptar más soluto de lo normal. De ahí el nombre de este tipo de solución.
Las fases de los componentes
- Sólidos. Componentes caracterizados por resistirse a cambios de forma y de volumen. Existen tres tipos:
- Sólido con sólido. Tanto el soluto como el solvente se encuentran en estado sólido; por ejemplo, las aleaciones de estaño y plomo utilizadas en soldadura.
- Sólido con gas. El solvente es sólido y el soluto un gas; por ejemplo, polvo volcánico y aerosol sólido.
- Sólido con líquido. El solvente es sólido y el soluto líquido; por ejemplo: amalgama dental (mercurio con plata).
- Líquidas. Componentes caracterizados por no poseer forma definida, pues adoptan la del recipiente que los contiene. Existen tres tipos:
- Líquido con sólido. El soluto es sólido y el solvente líquido; por ejemplo, agua con azúcar.
- Líquido con gas. El soluto es gas y el solvente líquido; por ejemplo, oxígeno con agua en las gaseosas.
- Líquido con líquido. Tanto el solvente como el soluto son líquidos; por ejemplo, los anticongelantes.
- Gaseosas. Componente cuyas partículas se encuentran muy separadas, así que adoptan el volumen y forma del recipiente que las contiene. Existen tres tipos:
- Gas con sólido. El soluto es sólido y el solvente gaseoso; por ejemplo, polvo disuelto en el aire.
- Gas con líquido. El soluto es líquido y el solvente un gas; por ejemplo, bebidas gaseosas.
- Gas con gas. Tanto el soluto como el solvente son gaseosos; por ejemplo, perfume disuelto en el aire.
Medidas de concentraciones de soluciones químicas: porcentajes, partes por millón, molaridad, fracción molar, molalidad, % volumen/volumen, % peso/peso y % peso/volumen
La concentración se puede definir como la unidad que describe las proporciones del soluto presentes en el disolvente de una solución. Se puede expresar por medio de dos tipos de unidades: físicas y químicas.
- Físicas. Son aquellas que se expresan en relación con el peso o volumen de las soluciones, se representan en forma porcentual y se multiplican por 100.
- %peso/peso. Se representa por el gramo del soluto sobre los gramos de la solución.
- %volumen/volumen. Se representa en centímetros cúbicos (cc) del soluto sobre los cc de la solución.
- %peso/volumen. Se da cuando se combinan las dos anteriores y se representa en gramos del soluto sobre el cc de la solución.
- Químicas. Aquellas que se expresan por medio de las unidades químicas.
- Molaridad (M). Se representa en números de moles de soluto sobre litros de la solución. La siguiente forma es
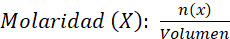 de disolución
y se expresa en moles/disolución.
de disolución
y se expresa en moles/disolución.
- Fracción molar. Se representa en moles de uno de los componentes, ya sea el soluto o el solvente, en relación con los moles totales de la solución.
- Molalidad (m). Es la relación entre el número de moles, ya sea del soluto o del solvente, por kilogramos de disolventes. Se puede calcular a partir de
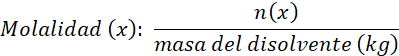 y se expresa en unidades de mol/kg.
y se expresa en unidades de mol/kg.

Ahora que conoces la importancia de las soluciones químicas, sus características, fases y tipos, te será más fácil identificar y clasificar las sustancias que te rodean. La mayoría de las soluciones se realizan entre un líquido y un sólido; por ejemplo, nuestros alimentos se degradan por el jugo gástrico del estómago y forma una solución que poco a poco absorbe nuestro cuerpo. Las soluciones son parte fundamental de nuestras vidas, pues están presentes tanto en el café de la mañana como en nuestra propia circulación sanguínea; por eso, es importante que comprendas bien los términos y la forma de expresar sus componentes.

 El desarrollo y la evolución de la tecnología han provocado que el ser humano genere mezclas a partir de diferentes sustancias. Todo comenzó por la curiosidad de saber qué pasaría y hoy en día dichas combinaciones resultan fundamentales para desarrollar nuevos productos. Al indagar un poco más en la formación, estado y fuerzas químicas de estas nuevas soluciones, se logró determinar lo que permite a la materia entremezclarse y permanecer unida. Este descubrimiento representó un avance muy significativo en diferentes ciencias: biología, química, geología, geoquímica, entre otras.
El desarrollo y la evolución de la tecnología han provocado que el ser humano genere mezclas a partir de diferentes sustancias. Todo comenzó por la curiosidad de saber qué pasaría y hoy en día dichas combinaciones resultan fundamentales para desarrollar nuevos productos. Al indagar un poco más en la formación, estado y fuerzas químicas de estas nuevas soluciones, se logró determinar lo que permite a la materia entremezclarse y permanecer unida. Este descubrimiento representó un avance muy significativo en diferentes ciencias: biología, química, geología, geoquímica, entre otras.
 Las soluciones químicas se pueden clasificar por medio de dos criterios: el soluto y el disolvente.
Las soluciones químicas se pueden clasificar por medio de dos criterios: el soluto y el disolvente.


