
 La ley de conservación de la materia señala que “la materia no se crea ni se destruye, solo se transforma” (Lavoisier, 1785, en Chang, 2020); según este principio, resulta indispensable conocer cuándo se da una reacción química, así como el número de átomos o la cantidad de reactivos involucrados que dieron origen a los productos. En estos casos, se precisa del balanceo o equilibrio de la ecuación para indicar la medida requerida de un reactivo para generar una cantidad específica de alguna sustancia. En esta experiencia de aprendizaje, se explicará cómo balancear una ecuación química y los conceptos necesarios para ello (Chang, 2020).
La ley de conservación de la materia señala que “la materia no se crea ni se destruye, solo se transforma” (Lavoisier, 1785, en Chang, 2020); según este principio, resulta indispensable conocer cuándo se da una reacción química, así como el número de átomos o la cantidad de reactivos involucrados que dieron origen a los productos. En estos casos, se precisa del balanceo o equilibrio de la ecuación para indicar la medida requerida de un reactivo para generar una cantidad específica de alguna sustancia. En esta experiencia de aprendizaje, se explicará cómo balancear una ecuación química y los conceptos necesarios para ello (Chang, 2020).

Ecuaciones químicas que resultan de situaciones o experimentos científicos

Coeficiente de reactivos y productos
Normalmente, en los laboratorios es muy importante conocer la cantidad de reactivos utilizados para las reacciones químicas, ya que el personal tiene que saber si cuenta con el material necesario; asimismo, se debe estimar qué tanto producto se generará de la reacción y determinar si es o no suficiente. Para calcular esta información existen los coeficientes de reactivos y productos.
![]()
En la fórmula anterior, a la izquierda de la flecha encontramos a los reactivos y a la derecha a los productos; por su parte, X representa a los coeficientes de ambos.
Átomos de elementos y compuestos en ecuaciones químicas
El balanceo de ecuaciones se refiere al equilibrio de los átomos presentes en los reactivos de los productos. Existen dos formas para llevarlo a cabo: por tanteo y por óxido-reducción.
Para balancear por tanteo, sigue estos pasos:
Ejemplo: Fe + H2SO4 ![]() Fe2 (SO4)3 + H2.
Fe2 (SO4)3 + H2.
Reactivos: Fe (hierro) + H2SO4 (ácido sulfúrico).
Productos: Fe2(SO4)3 (sulfato de hierro) + H2 (hidrógeno).
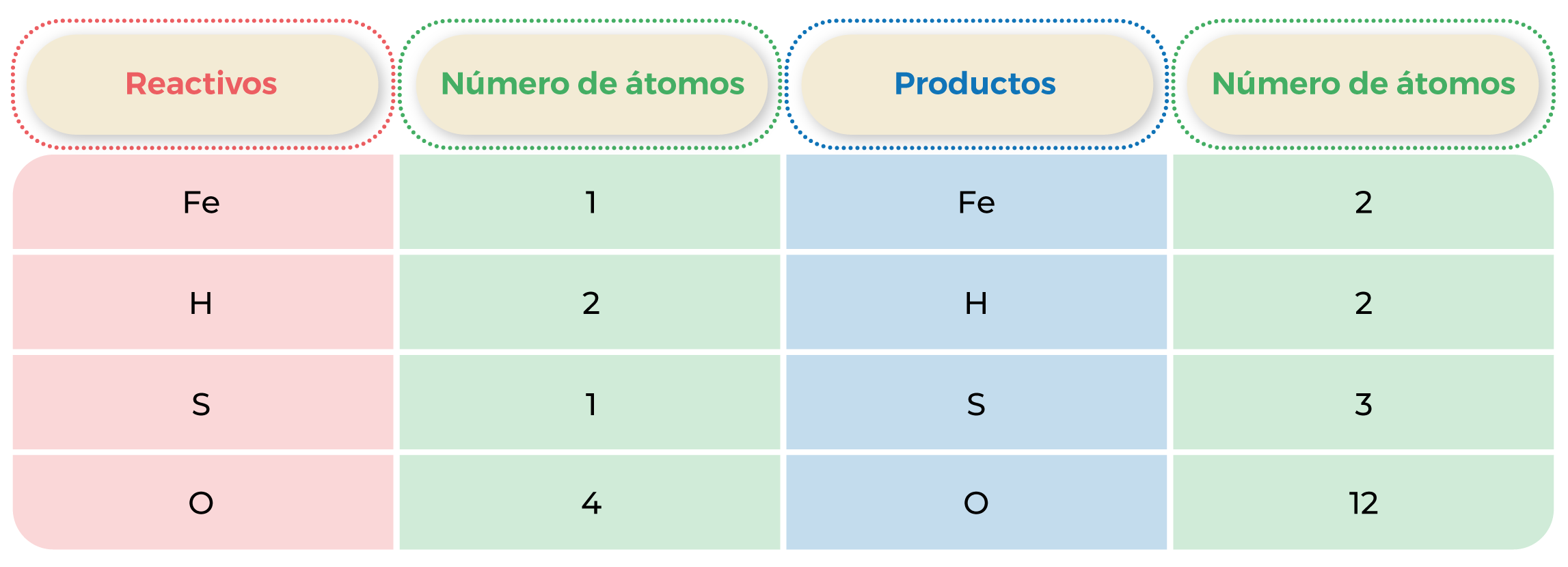
Tabla 1. Número de átomos en la reacción.
2Fe + 3H2SO4 ![]() Fe2(SO4)3 + 3H2
Fe2(SO4)3 + 3H2
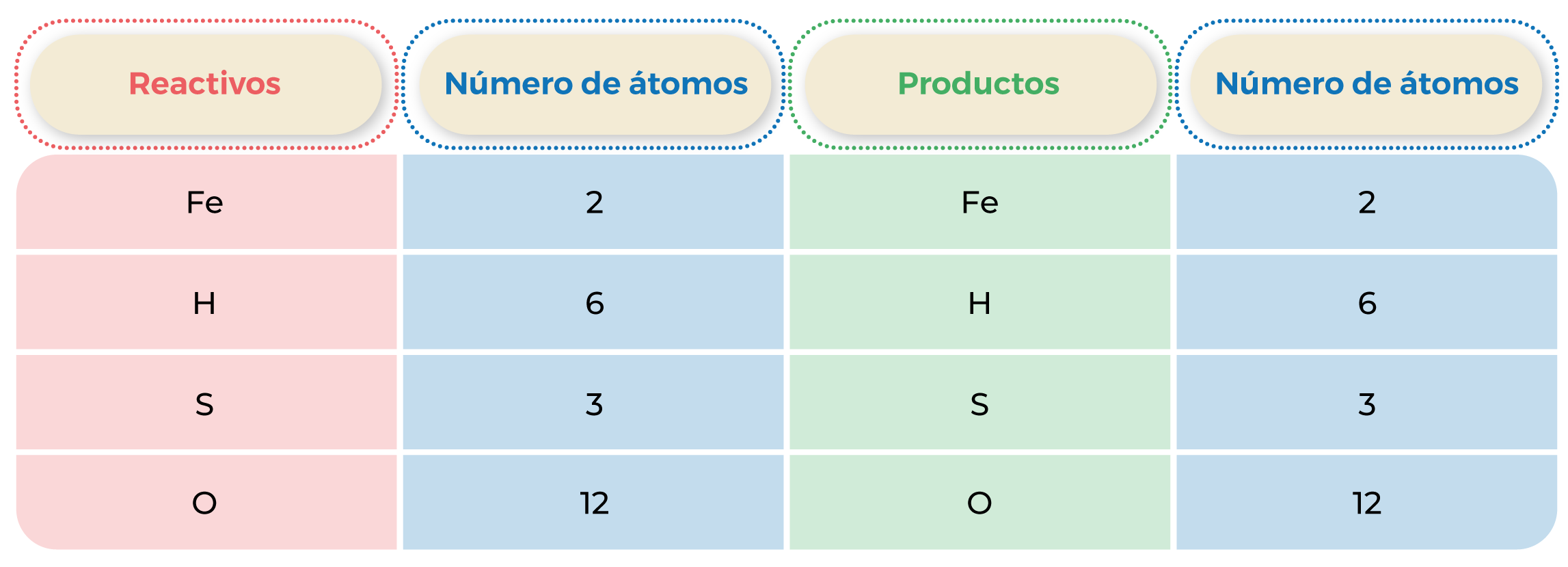
Tabla 2. Comprobación del balanceo de la ecuación.
Para balancear por óxido-reducción, observa con atención los siguientes pasos:
FeO + C → Fe + CO2
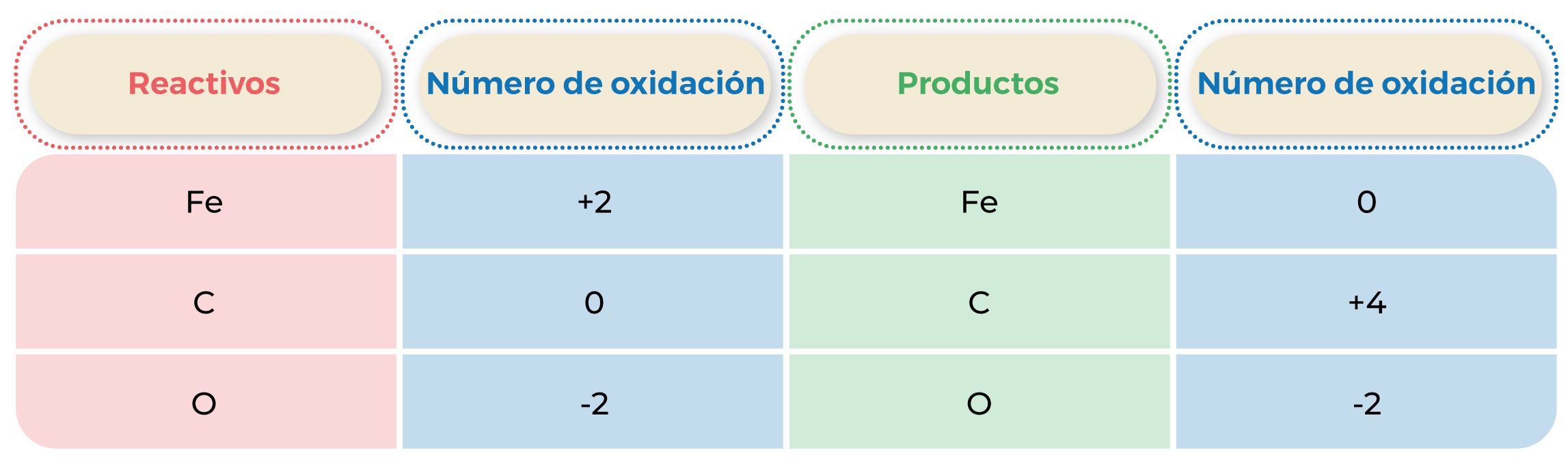
Tabla 3. Números de oxidación.
Número de oxidación. Se le asigna a cada átomo para representar el número de electrones perdidos, ganados o compartidos.
En una reacción de oxidación-reducción (redox), existe la transferencia de electrones de un elemento o sustancia a otra, es decir, si uno los pierde, el otro debe ganarlos. Por tanto, la oxidación se define como una “pérdida de electrones”, mientras que la reducción alude a una ganancia de dichas partículas.
El número de oxidación de C aumenta de 0 a +4, así que se oxida.
El número de oxidación de Fe disminuye de + 2 a 0, así que se reduce.
2FeO + C → 2Fe + CO2
2FeO + C → 2Fe + CO2
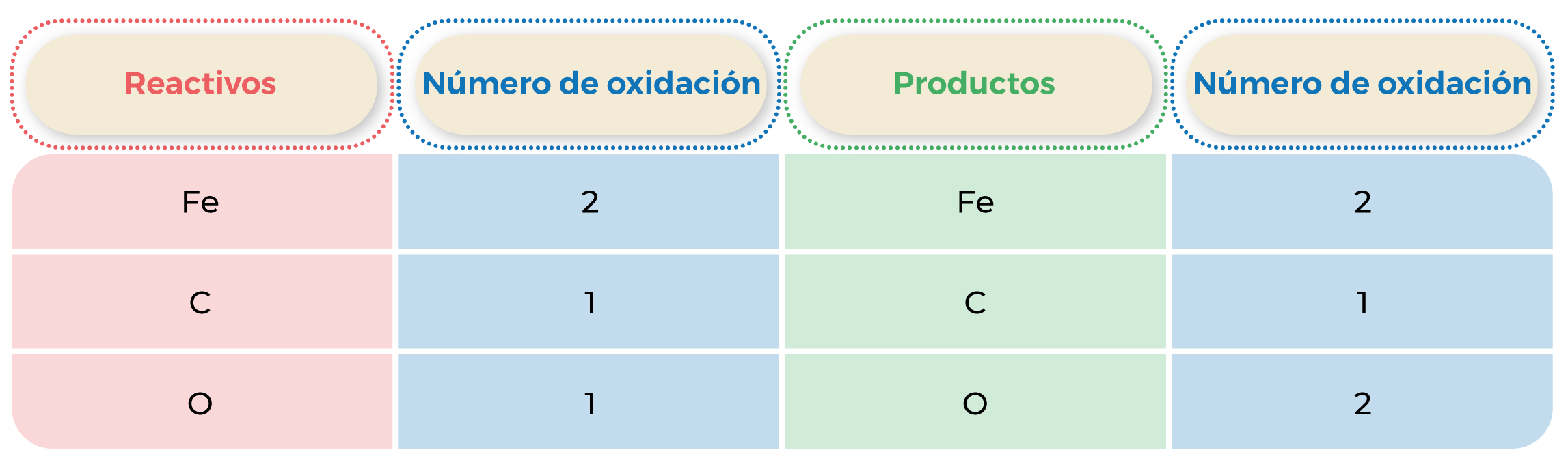
Tabla 4. Comprobación del número de átomos.

Revisa a fondo los conceptos y partes necesarias para lograr balancear una ecuación. Las grandes empresas necesitan ejecutar de manera eficiente dichas reacciones para generar sus productos, ya que el desperdicio de materiales o reactivos se traduce a pérdidas millonarias; por tanto, comprender bien las ecuaciones químicas y su balanceo redunda en un mejor rendimiento y reduce las posibles pérdidas. Así como las grandes empresas consideran importante este tema, todos debemos entenderlo y valorar los múltiples beneficios que las reacciones químicas nos brindan en la vida diaria.

Asegúrate de:

