
 ¿Sabías que en las reacciones químicas existe una ley de conservación de la masa y la energía? La estequiometría química y la termodinámica se basan en este principio; por tanto, se deben respetar las cantidades de materia y energía tanto en los reactivos como en los productos derivados de una reacción. Para cumplir con las medidas precisas, existen diversos procedimientos algebraicos; por ejemplo, el balanceo químico, entalpía de formación y el equilibrio químico de reacción.
¿Sabías que en las reacciones químicas existe una ley de conservación de la masa y la energía? La estequiometría química y la termodinámica se basan en este principio; por tanto, se deben respetar las cantidades de materia y energía tanto en los reactivos como en los productos derivados de una reacción. Para cumplir con las medidas precisas, existen diversos procedimientos algebraicos; por ejemplo, el balanceo químico, entalpía de formación y el equilibrio químico de reacción.

Reacciones de estequiometría
La estequiometría es la rama de la química encargada de la relación cuantitativa entre reactivos y productos durante una reacción, así que permite a los científicos predecir la cantidad de reactivos necesarios para producir una cantidad específica de producto. Esto se realiza mediante la ecuación química balanceada, que expresa la relación del número de moles o gramos de cada sustancia involucrada en el proceso. Asimismo, las reacciones estequiométricas se rigen por la ley de conservación de la materia, es decir, la que postula que al realizar una reacción química en un sistema aislado, todo el sistema permanecerá constante. En otras palabras, todas las unidades de los reactivos se convertirán en productos, como sucede en este ejemplo:
![]()
En la reacción de yoduro de sodio acuoso con nitrato de plomo (II) acuoso, puedes observar que se cumple la ley de conservación de la materia, ya que se tiene la misma cantidad tanto en el lado de los reactivos como en el de los productos: en el primero, 2 Na, 2 I, 1 Pb y 2 NO3-; por su parte, en el segundo, 1 Pb, 2 I, 2 Na y 2 de NO3-. Entonces, la relación estequiométrica del ejemplo anterior se explica de esta manera: por cada 2 moles de NaI se obtiene uno de PbI2 y dos de NaNO3; mientras que por cada mol de Pb(NO3)2 se consigue uno de PbI2 y dos de NaNO3. Dicho en otras palabras, por cada 2 moles de NaI se requiere uno de Pb(NO3)2 para conseguir uno de PbI2 y dos de NaNO3.
Gramos y moles de reactivos y productos
En el apartado anterior, se habló de las reacciones estequiométricas, pero ¿cómo se realizan los cálculos estequiométricos a partir de una reacción química? Estos conllevan tres pasos:
A continuación, se presenta un ejemplo práctico que te ayudará a comprender mejor los cálculos estequiométricos.
Pedro tiene una solución de nitrato de plata (AgNO3, PM=169.9 g/mol), pero desconoce su concentración; para determinarla, decide realizar un análisis gravimétrico por precipitación con una solución de Na2CO3 (106.0 g/mol) y obtiene un precipitado amarillento (Ag2CO3, PM=275.7 g/mol) con una masa de 6.06 g. De acuerdo con la reacción estequiométrica:
![]()
![]()
![]() .
.
![]()
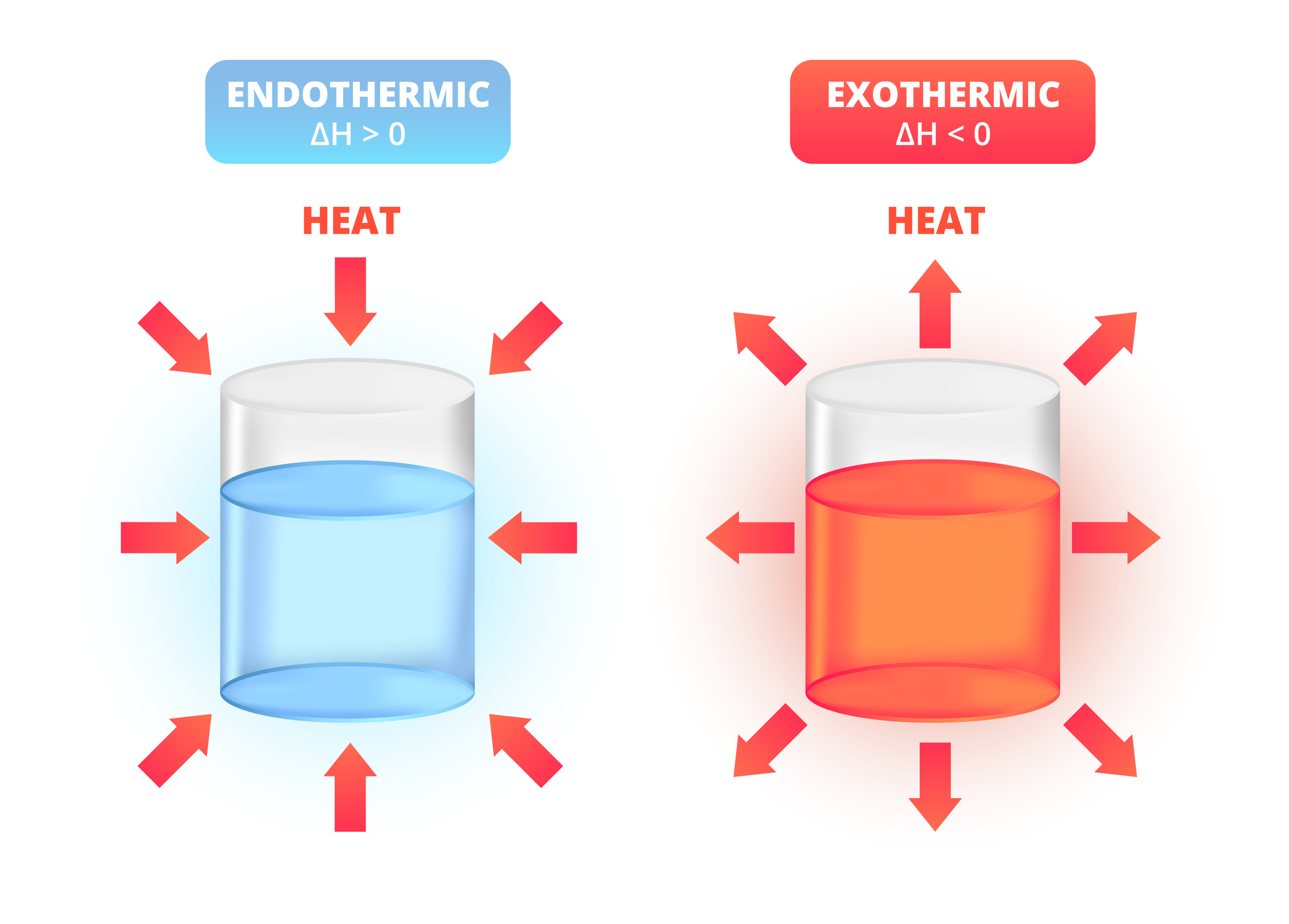
Además de la materia, en una reacción también participa la energía; a la rama de la química que estudia estos procesos se le denomina “termodinámica”. La interacción de la energía en una reacción se rige bajo la primera ley de la termodinámica, conocida como la ley de conservación de la energía, la cual postula que “en un sistema físico aislado, la cantidad de energía total será la misma a través del tiempo” (Chang, 2020). Aunque esta puede adquirir otras formas, una de las más comunes es el calor. Bajo este principio, durante una reacción química se pueden tener dos tipos de procesos termodinámicos: endotérmicos y exotérmicos.
Ejemplos de procesos endotérmicos y exotérmicos
Los procesos o reacciones endotérmicas ocurren cuando se administra energía al sistema para que se lleve a cabo la reacción. Un ejemplo de esto se da en la descomposición del óxido de mercurio (II) a mercurio elemental Hg0 y a oxígeno elemental O2, pues se necesita energía para que comience el proceso:
![]()
A diferencia de los anteriores, en los procesos o reacciones exotérmicas hay una liberación de energía hacia el sistema físico en forma de calor; por ejemplo, la formación de moléculas de agua mediante la reacción de H2 (g) y O2 (g) entra en esta categoría porque desprende calor.
![]()
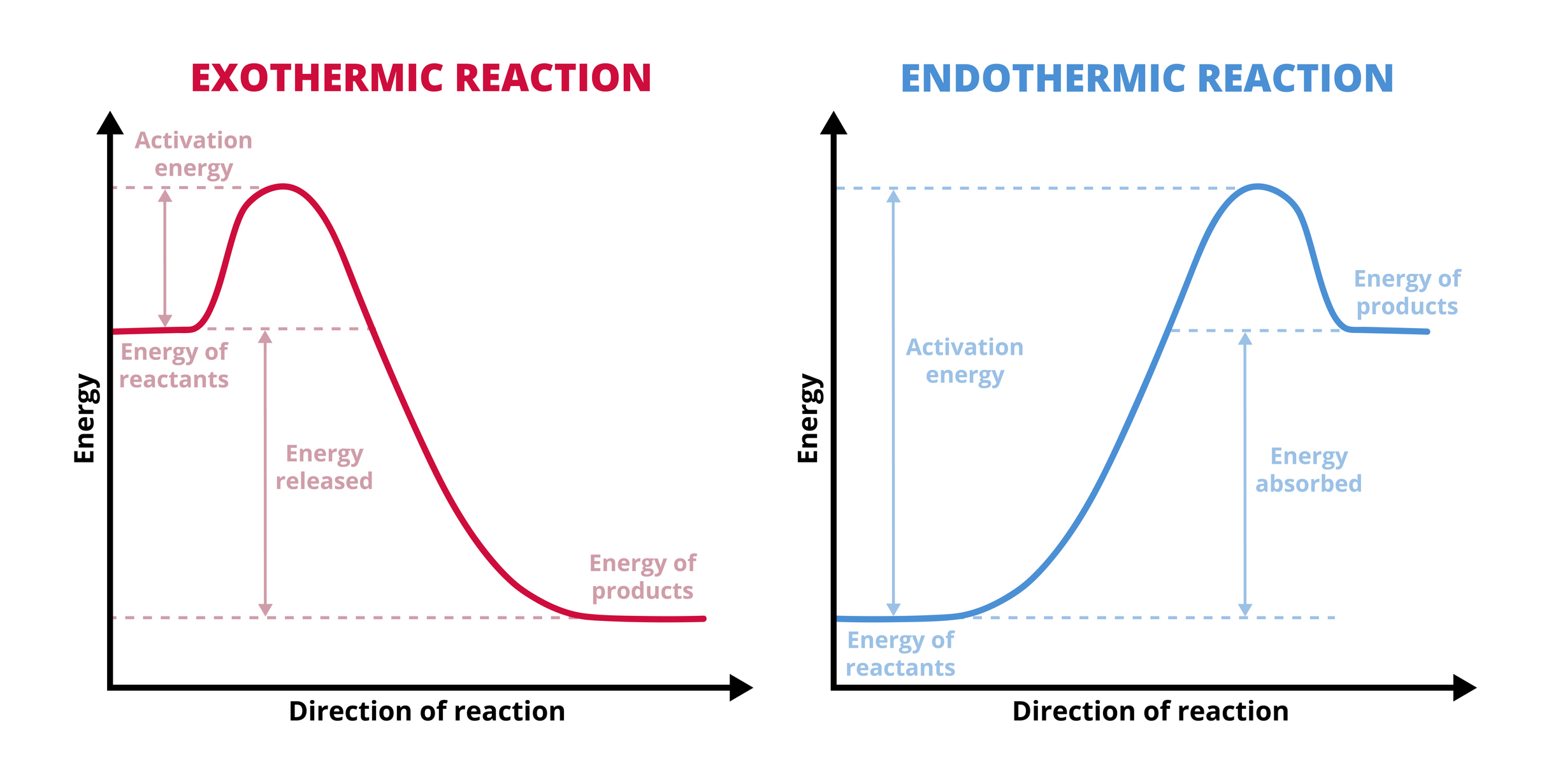
Observa el siguiente ejemplo:
![]()
En la reacción de 1 mol de nitrógeno más tres de hidrógeno, se generan 3 moles de amoniaco y, además, se libera energía; por consiguiente, se trata de una reacción exotérmica.
En este otro caso, hay una reacción de gas metano más oxígeno, que produce dióxido de carbono y agua, así como liberación de energía.
![]()
![]()
Al observar la ecuación, puedes apreciar que se necesitó añadir energía para llevar a cabo la reacción, ya que esta se encuentra del lado izquierdo, es decir, de los reactivos; por ende, se trata de un proceso endotérmico.
Valor de entalpía
¿Cómo se determina si un proceso es exotérmico o endotérmico? Esto se sabe mediante la determinación de los valores de entalpía de enlace, que representa la cantidad de energía absorbida o liberada cuando se produce un mol de compuesto durante una reacción química. Para conocer la entalpía de formación, se determina la diferencia de energía de los productos con respecto a los reactivos mediante la siguiente ecuación:
![]()
Debido a la naturaleza de la ecuación, se pueden obtener valores de entalpía (ΔH) negativos o positivos. Estos últimos se dan cuando la sumatoria de la energía del lado de los productos es mayor a la de los reactivos, ya que esto significa que se tuvo que administrar energía a la reacción; por tanto, se trata de un proceso endotérmico. Los valores de entalpía negativos ocurren a la inversa, es decir, cuando la sumatoria de energía de los reactivos es mayor a la de los productos; entonces, hay una liberación de energía en forma de calor y se trata de un proceso exotérmico.
Por último, cabe señalar que durante una reacción nunca se produce la conversión completa de los reactivos a productos; en lugar de esto, sucede un estado de equilibrio químico donde la relación de las concentraciones de reactivos y productos se mantiene constante. ¿Cómo se expresan las constantes de equilibrio de una reacción? Estas se determinan mediante ecuaciones algebraicas que describen el vínculo entre las concentraciones de reactivos y productos en su estado de equilibrio químico. Para ello, hay que considerar la siguiente ecuación:
![]()
Las letras mayúsculas representan las fórmulas de los reactivos y productos, mientras que los subíndices señalan los números totales necesarios para balancear la ecuación química. Dicho de otra manera, se necesita partir de la reacción estequiométrica y, por tanto, la ecuación de la constante de equilibrio queda de la siguiente forma:
![]()
Constante de equilibrio
En química, existen diversos tipos de equilibrio y, por ende, distintas constantes de equilibrio químico; sin embargo, todas siguen el mismo principio. En la siguiente tabla se presentan las más comunes (Chang, 2020):
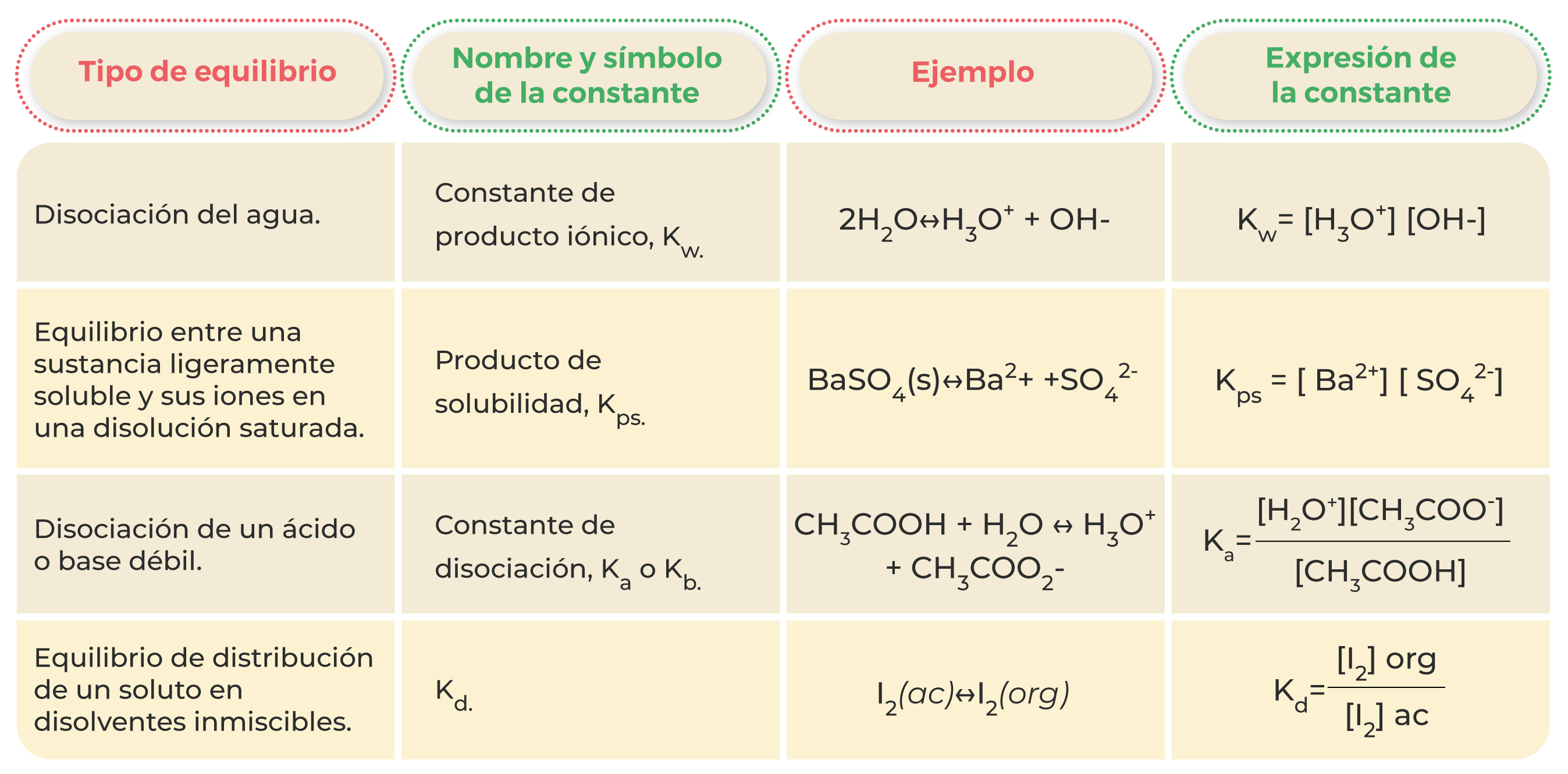
Tabla 1. Ejemplos de equilibrios y constantes de equilibrio químico.

En las ciencias químicas, estequiometría y termodinámica son disciplinas de suma importancia, ya que brindan los parámetros para entender cómo suceden las reacciones. La estequiometría permite comprender la interacción de la materia y la manera de conseguir una relación entre reactivos y productos. Por su parte, la termodinámica establece los parámetros de la interacción de la energía en la reacción y los expresa como valores de entalpía de formación.

Asegúrate de:

