
 Para el estudio de la química es necesario contar con un lenguaje, símbolos y señas que ayuden a comprender lo que se observa y descubre; esto permite expresar el conocimiento de una forma accesible para todas las personas. De igual forma, surgió la necesidad de examinar el estado de agregación de reactivos y productos generados mediante una reacción química. Los hallazgos se codificaron y asimilaron a lo largo del mundo, así que en este tema comprenderás los elementos principales de dichos fenómenos, es decir, su lenguaje y significados.
Para el estudio de la química es necesario contar con un lenguaje, símbolos y señas que ayuden a comprender lo que se observa y descubre; esto permite expresar el conocimiento de una forma accesible para todas las personas. De igual forma, surgió la necesidad de examinar el estado de agregación de reactivos y productos generados mediante una reacción química. Los hallazgos se codificaron y asimilaron a lo largo del mundo, así que en este tema comprenderás los elementos principales de dichos fenómenos, es decir, su lenguaje y significados.

Tipos de reacciones químicas en ecuaciones químicas balanceadas
 Reacciones químicas. Una reacción química se origina cuando las sustancias reaccionan entre sí y generan un producto nuevo a partir de compuestos diferentes. En estos casos, se sigue la ley de la conservación de la materia, ya que los átomos de los reactivos se rompen y se reordenan para formar nuevos enlaces y materiales.
Reacciones químicas. Una reacción química se origina cuando las sustancias reaccionan entre sí y generan un producto nuevo a partir de compuestos diferentes. En estos casos, se sigue la ley de la conservación de la materia, ya que los átomos de los reactivos se rompen y se reordenan para formar nuevos enlaces y materiales.
Ecuación química. Por medio de ella, se representan las reacciones químicas mediante símbolos y fórmulas, pues identifica productos y reactivos. Para poder generarla, se necesita saber cómo reaccionan las sustancias, qué productos formarán y, además, contar con la ecuación balanceada (Portal Académico UNAM, s.f.).
Para identificar si se ha producido o no una reacción química, debe ocurrir alguno de estos sucesos:
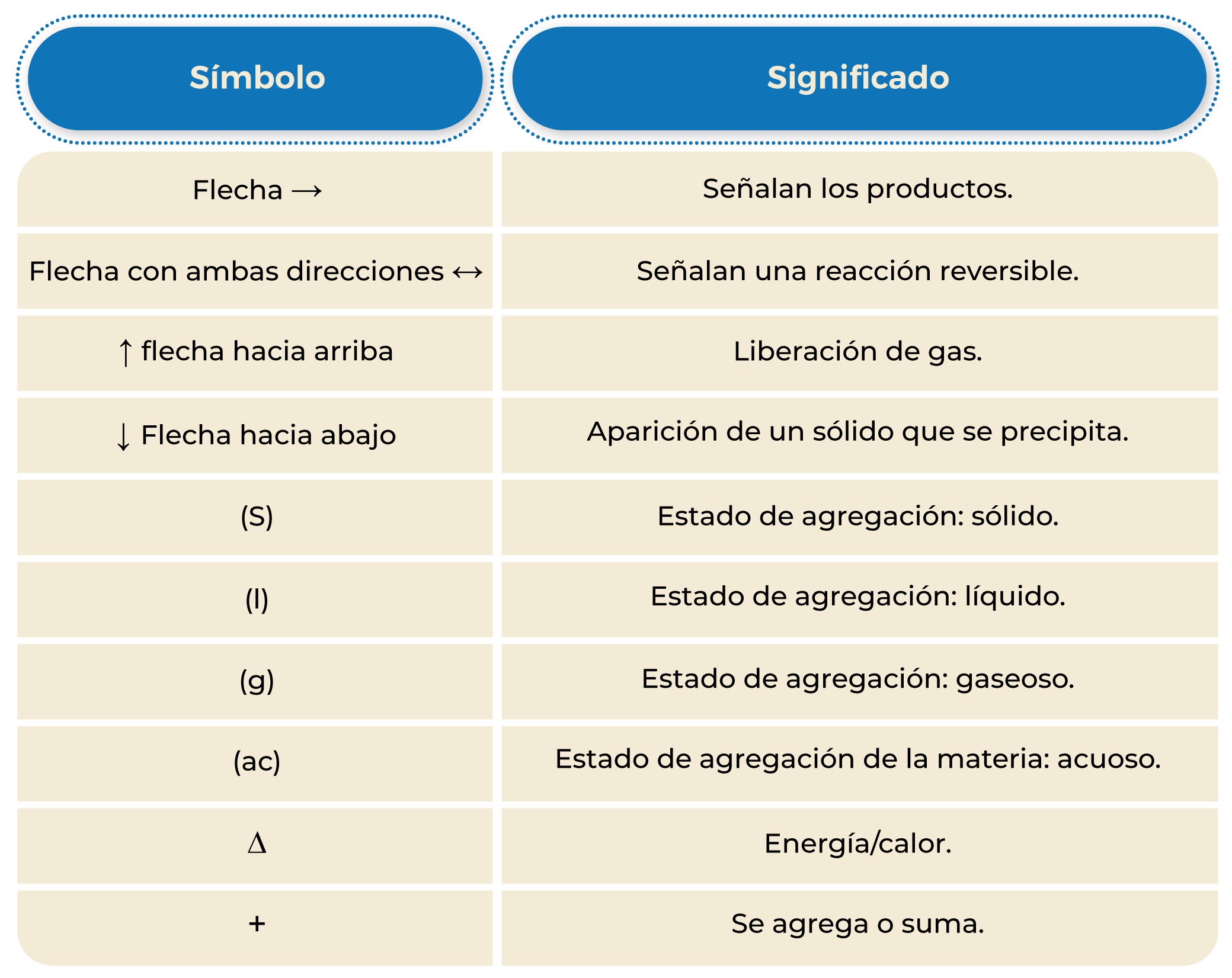
Tabla 1. Símbolos utilizados en las reacciones químicas.
Tipos de reacciones químicas
Reacciones de síntesis. Se caracterizan por la unión de dos o más elementos y la formación de un producto nuevo.
![]()
A y B representan a los reactivos y AB al producto. Ejemplo: la unión de oxígeno con azufre origina dióxido de azufre.
![]()
![]()
Las reacciones por descomposición suelen ser indeseadas, ya que al exponerlas a condiciones extremas (calor, electricidad, radiación, etc.) su estabilidad se ve comprometida y ocurre la separación de sus elementos.
Por ejemplo, cuando el óxido de mercurio (II) se calienta, se producen mercurio y oxígeno.
![]()
![]()
Por ejemplo, el zinc sustituye al hidrógeno en el ácido clorhídrico HCl (ac).
![]()
![]()
Por ejemplo, cuando el nitrato de plata reacciona con el cloruro de sodio, se produce un precipitado (cloruro de plata) más la formación de nitrato de sodio.
![]()
Las reacciones también se clasifican mediante la cuantificación de la energía usada o liberada y reciben el nombre de reacciones exotérmicas; en ellas, durante la interacción de los reactivos se libera la suficiente energía para aumentar la temperatura. Por otro lado, cuando la energía es atrapada por la reacción, se necesita calor para que esta se lleve a cabo; este fenómeno se denomina reacción endotérmica y provoca una disminución de temperatura (Chang, 2022).


La colaboración entre las distintas áreas científicas, así como la necesidad de comunicar los hallazgos a la sociedad general, ha promovido la invención de complejas señales y formas de transmitir la información. En este sentido, se debe comprender qué es una reacción química, sus características y formulación; de esta manera, será posible entender este fenómeno, sus transformaciones, cómo se produce y forma tanto en la naturaleza como en el laboratorio.

Asegúrate de:

