
 El carbono es uno de los elementos más abundantes del planeta, la existencia misma se debe gracias a él y las condiciones de vida serían muy diferentes si no lo tuviéramos como materia prima en la elaboración de productos básicos, como saborizantes, jabones, aceites, fármacos, entre muchos otros.
El carbono es uno de los elementos más abundantes del planeta, la existencia misma se debe gracias a él y las condiciones de vida serían muy diferentes si no lo tuviéramos como materia prima en la elaboración de productos básicos, como saborizantes, jabones, aceites, fármacos, entre muchos otros.
Una rama de la química, denominada química orgánica, se encarga del estudio del átomo de carbono y sus compuestos. Los antiguos científicos llamaban orgánicas a las sustancias obtenidas de fuentes vivas, es decir, derivadas de plantas y animales. Sin embargo, cuando dichos materiales se sintetizaron en un laboratorio, esta idea se deshecho. Hoy en día se conocen más de 20 millones de compuestos orgánicos, por lo que el estudio del átomo de carbono es fundamental para el ser humano.

Propiedades e hibridación del átomo de carbono
 Uno de los elementos más importantes del planeta tierra es el carbono, ya que se trata de un componente esencial de la materia orgánica. Se presenta en diferentes estructuras y formas, sus propiedades físicas son muy estables, así que dan una mayor estabilidad a los compuestos que forma.
Uno de los elementos más importantes del planeta tierra es el carbono, ya que se trata de un componente esencial de la materia orgánica. Se presenta en diferentes estructuras y formas, sus propiedades físicas son muy estables, así que dan una mayor estabilidad a los compuestos que forma.
En la tabla periódica, el átomo de carbono se representa con el símbolo C, su número atómico es 6 y su masa atómica 12; esto significa que posee 6 protones y 6 neutrones en su núcleo, así como 6 electrones que giran alrededor de dicho centro. Posee una estructura 1s22s22p6. Pertenece al grupo 14 de la tabla periódica, junto al silicio (Si), germanio (Ge), estaño (Sb) y plomo (Pb). Todos ellos pueden formar enlaces con otros elementos, pero ninguno lo hace con tanta facilidad y estabilidad como el carbono.
El átomo de carbono cuenta con dos principales características que le permiten enlazarse a casi cualquier otro átomo:
Isótopos del carbono
Este concepto se refiere a los átomos que poseen en su núcleo el mismo número de protones, pero distinta cantidad de neutrones. En la tabla1 encontrarás los diferentes isótopos del carbono.
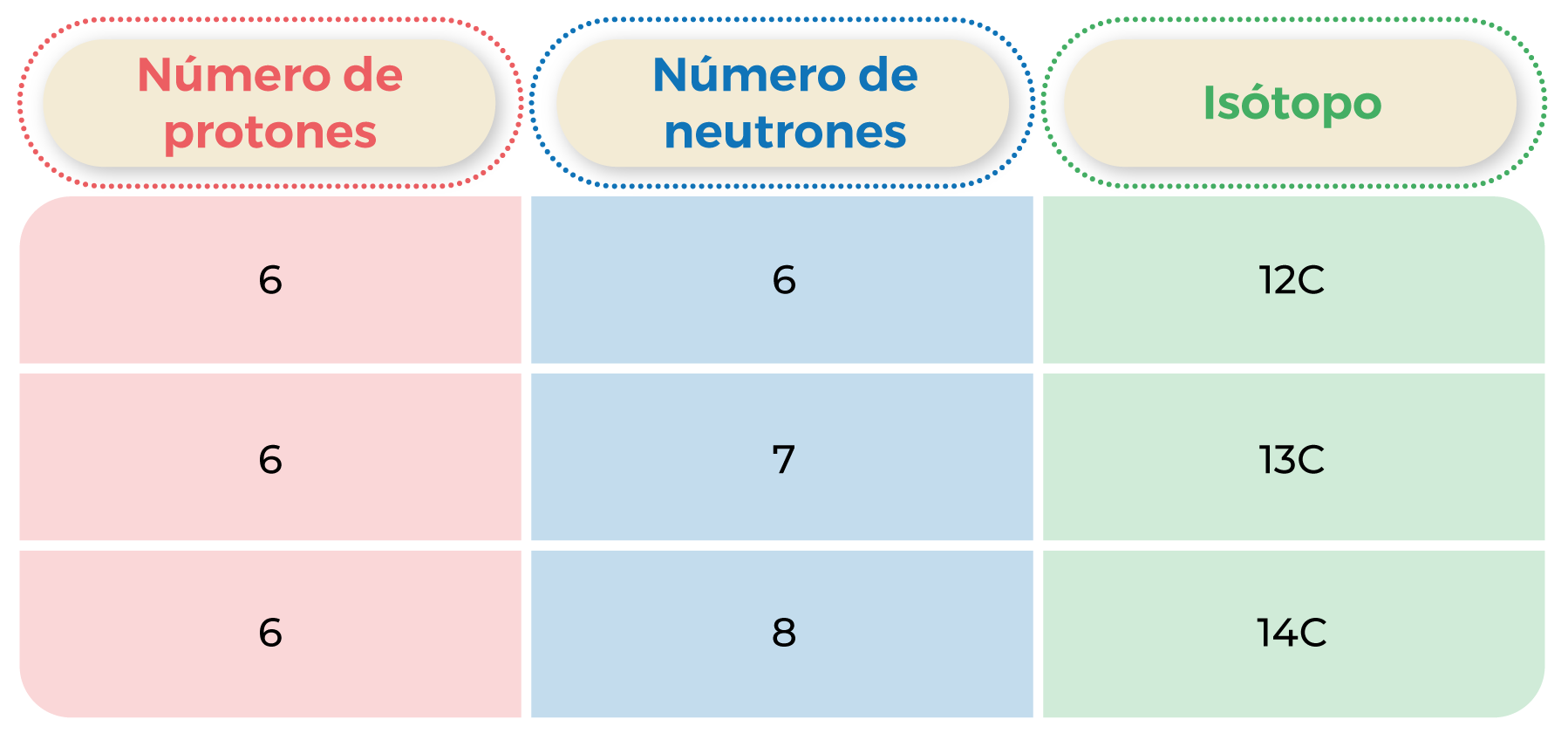
Tabla 1. Isótopos del carbono.
Fuente: Chang, R. (2020). Química (13ª ed.). Estados Unidos: McGraw Hill.
Estructura lineal y geometría de alcanos, alquenos y alquinos
Hibridación del átomo de carbono
Para la formación de compuestos químicos o unión de dos o más elementos, se necesita la formación de enlaces entre átomos. El de carbono es especial porque tiene la propiedad de enlazarse hasta con cuatro átomos diferentes, pues cuenta con 6 electrones rodeando el núcleo y distribuidos en diferentes niveles de energía. La configuración electrónica del carbono en su estado basal o natural es la siguiente:
1S2, 2S2, 2p2
Al menos en la naturaleza, el carbono tiene un número de oxidación +4 en los compuestos que forma, lo que le permite llegar a formar hasta cuatro enlaces (tetravalencia). Cuando el átomo de carbono recibe energía o excitación externa, los electrones brincan de nivel y ocupan los niveles mayores que se encuentran desocupados:
1s2, 2s1, 2px1, 2py1, 2pz1 (estado excitado).
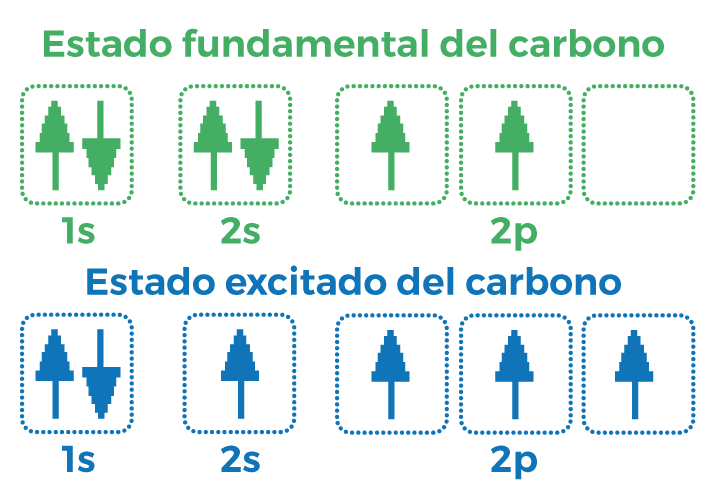
Imagen 1. Configuración electrónica del carbono.
Fuente: uimiTube.com. (s.f.). Configuración electrónica del estado fundamental y del estado excitado del átomo de carbono. Recuperado de https://www.quimitube.com/configuracion-electronica-estado-fundamental-y-estado-excitado-carbono/
Al área donde se puede encontrar a un electrón girando alrededor del núcleo del átomo, se le conoce como orbital atómico (s, p, d, f). En el ejemplo de la configuración electrónica del carbono, dichas partículas se localizan en los orbitales s y p.
Por su parte, la hibridación ocurre cuando se combinan varios orbitales atómicos para formar nuevos; este proceso los vuelve más estables y con la misma energía. La hibridación de los compuestos que posee el carbono se da entre este y los elementos con los que forma enlaces; estas uniones conforman una geometría de la molécula.
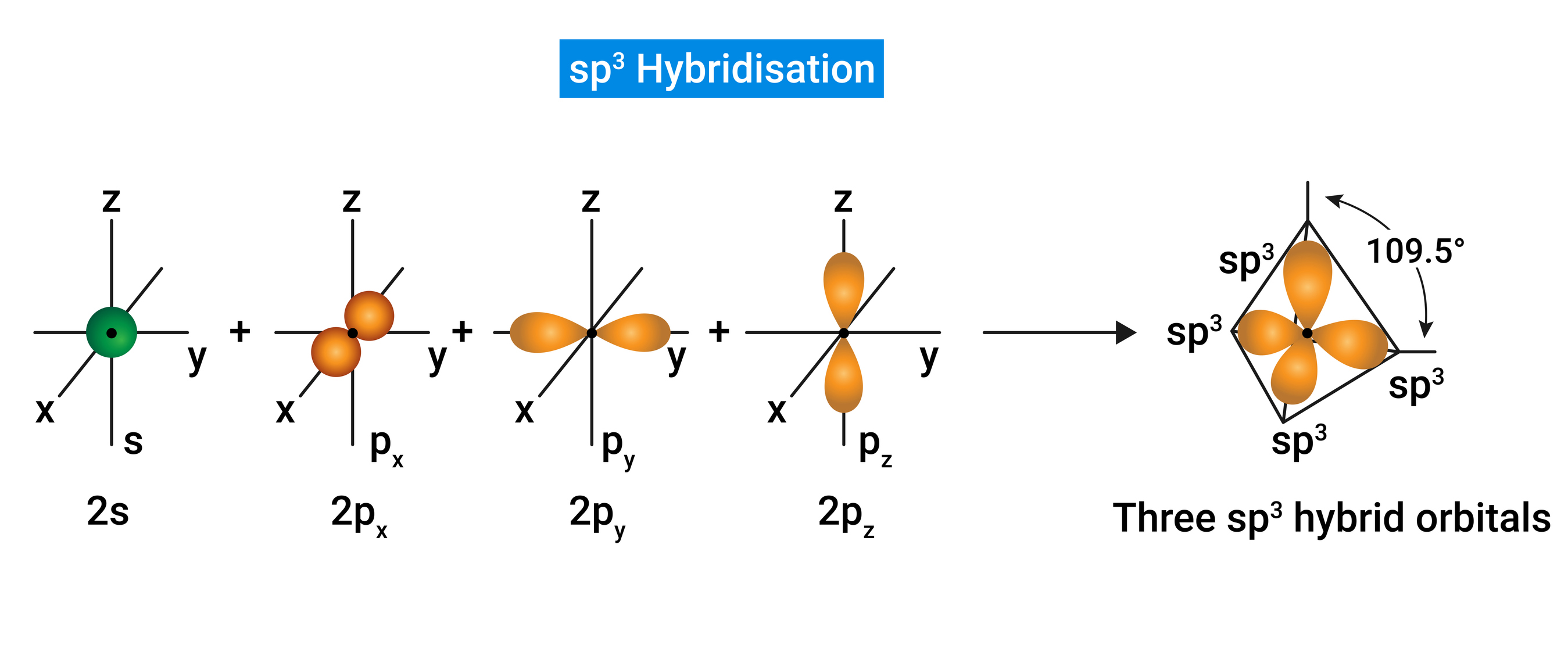

Como se mencionó anteriormente, el átomo de carbono es la base de la vida como se conoce hoy en día, ya que forma múltiples enlaces y tiene la capacidad de producir miles de compuestos diferentes. Debido a esta variedad, existe una rama de la química dedicada a estudiar los compuestos del carbono, es decir, la química orgánica. Esta disciplina se encarga de examinar todo lo que contiene carbono, desde fármacos hasta ropa. Por este motivo, la comprensión de las características del carbono es necesaria para generar nuevos compuestos, así como para entender mejor el entorno.

Asegúrate de:

