
 Todo ser viviente se compone de materia, es decir, de átomos. Estos no se encuentran solos o aislados, pues siempre interactúan entre sí y forman distintos tipos de enlaces, algunos fuertes y otros temporales; sin embargo, ambos enlaces resultan esenciales para la continuidad de la vida, ya que esta depende de sus diferentes propiedades, tanto físicas como químicas. ¿Por qué se forman los enlaces? ¿Cómo lo logran? En esta experiencia de aprendizaje contestarás estas preguntas.
Todo ser viviente se compone de materia, es decir, de átomos. Estos no se encuentran solos o aislados, pues siempre interactúan entre sí y forman distintos tipos de enlaces, algunos fuertes y otros temporales; sin embargo, ambos enlaces resultan esenciales para la continuidad de la vida, ya que esta depende de sus diferentes propiedades, tanto físicas como químicas. ¿Por qué se forman los enlaces? ¿Cómo lo logran? En esta experiencia de aprendizaje contestarás estas preguntas.

Tipos de enlaces químicos

¿Qué es un enlace químico?
El enlace químico se define como la combinación de átomos que forman un compuesto estable. En este proceso, los átomos comparten o ceden electrones y crean, así, sustancias homogéneas (Portal Académico UNAM, s.f.).
Electronegatividad
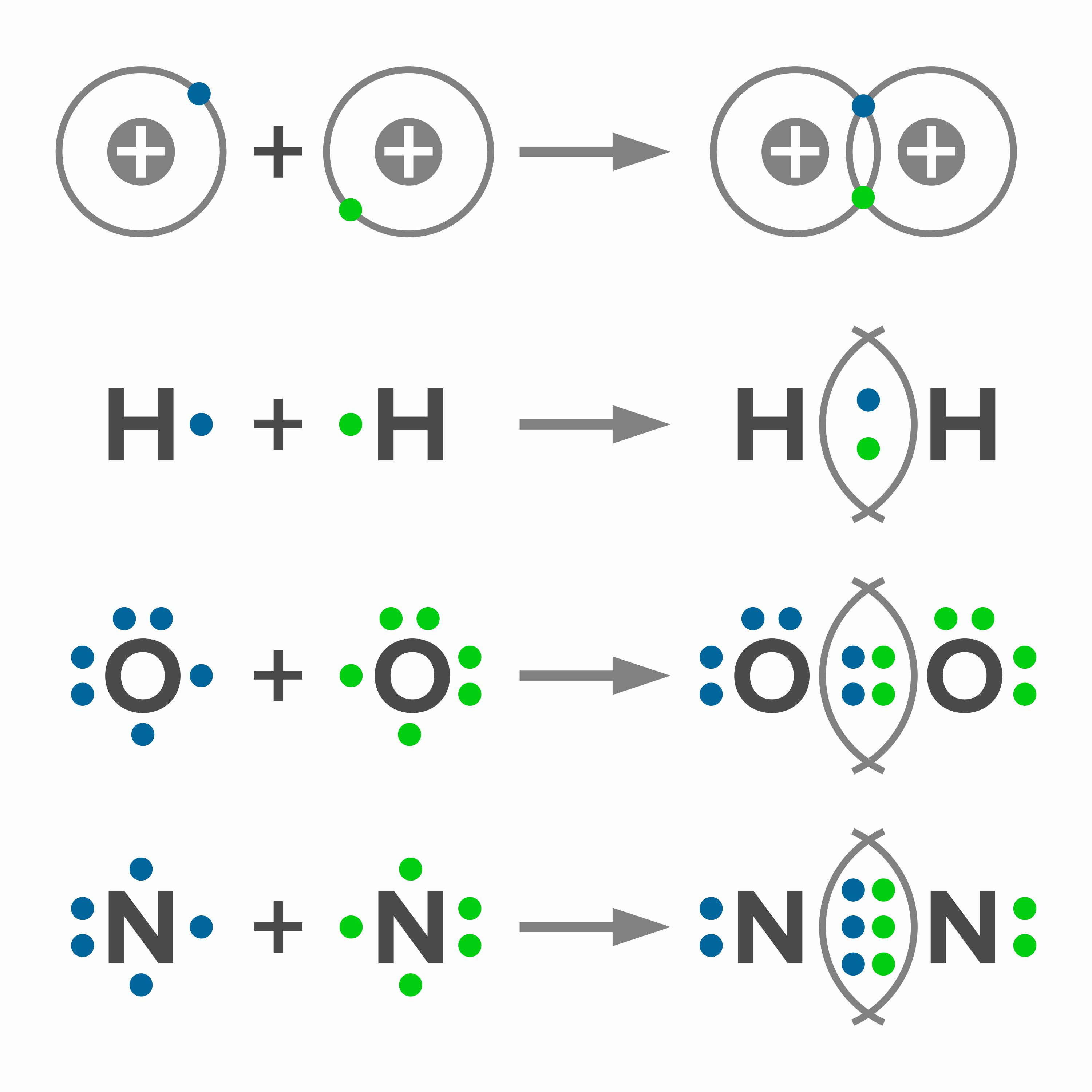
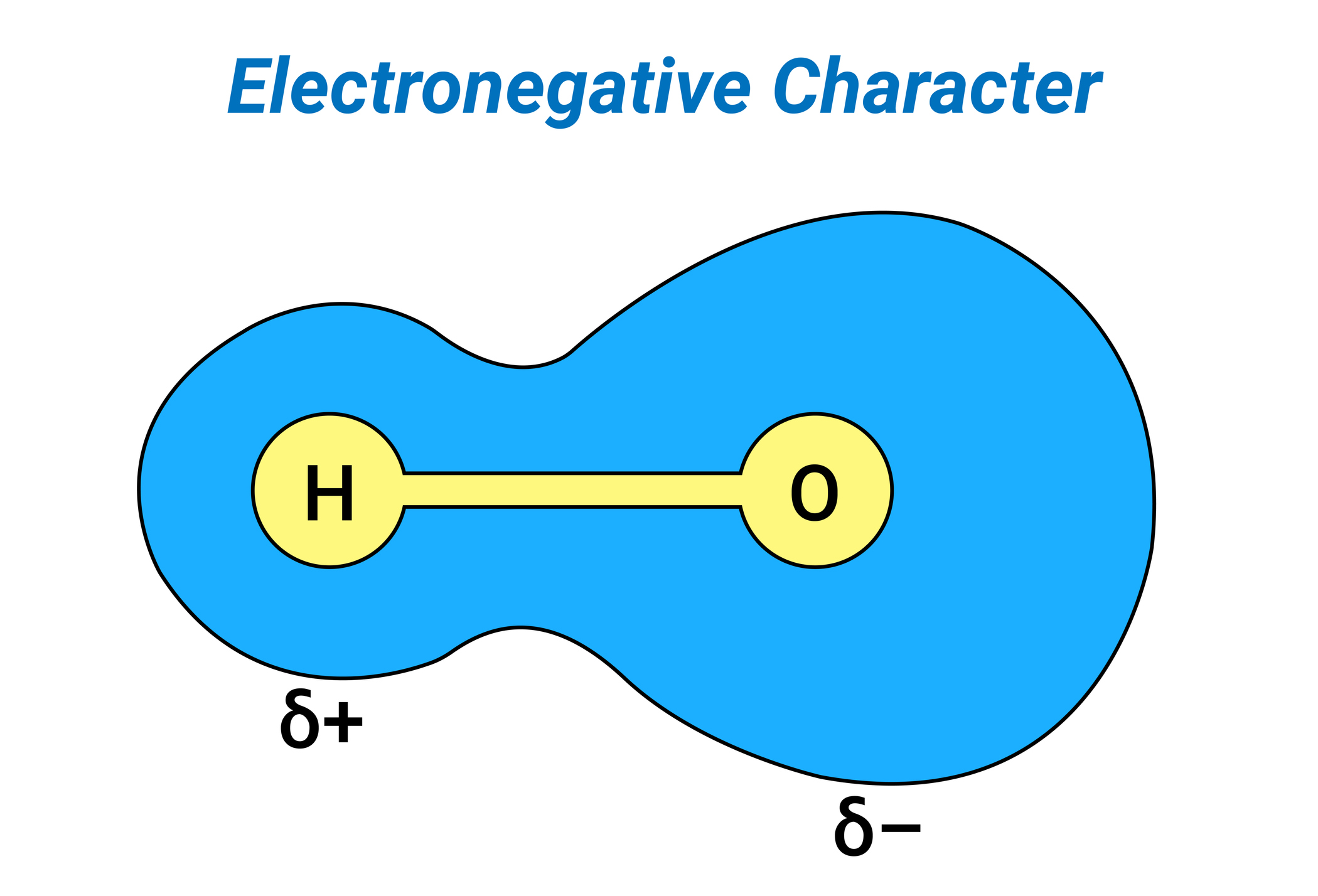 Alguna vez te has preguntado ¿cómo se forman los enlaces entre los distintos átomos? Esto ocurre gracias a la electronegatividad que poseen. Al respecto, el establecimiento de enlaces se puede interpretar como un estira y afloja entre átomos, ya que comparten dicha unión mediante sus electrones. Esta fuerza se denomina electronegatividad y se define como la capacidad que posee un átomo para atraer y retener el electrón de otro. Se trata de una propiedad periódica, es decir, se apoya en la tabla periódica y se relaciona con ella. Dicha tabla se organiza de la siguiente manera: aumenta de izquierda a derecha en relación con los periodos y de abajo hacia arriba de acuerdo con los grupos. Entonces, el elemento con mayor electronegatividad es el flúor (F) y el de menor resulta ser el francio (Fr).
Alguna vez te has preguntado ¿cómo se forman los enlaces entre los distintos átomos? Esto ocurre gracias a la electronegatividad que poseen. Al respecto, el establecimiento de enlaces se puede interpretar como un estira y afloja entre átomos, ya que comparten dicha unión mediante sus electrones. Esta fuerza se denomina electronegatividad y se define como la capacidad que posee un átomo para atraer y retener el electrón de otro. Se trata de una propiedad periódica, es decir, se apoya en la tabla periódica y se relaciona con ella. Dicha tabla se organiza de la siguiente manera: aumenta de izquierda a derecha en relación con los periodos y de abajo hacia arriba de acuerdo con los grupos. Entonces, el elemento con mayor electronegatividad es el flúor (F) y el de menor resulta ser el francio (Fr).
La electronegatividad se mide a partir de la unidad de Pauling, una escala que contempla del 4 al 0.7. Al ser una propiedad periódica, se puede establecer la diferencia de electronegatividad entre los átomos de los distintos enlaces químicos; esto se hace de manera muy sencilla: entre más alejados se encuentren en la tabla periódica, mayor será la diferencia de electronegatividad entre las partículas.
Por ejemplo, la diferencia entre el enlace covalente del flúor (4.0 Pauling) y el hidrógeno (2.1 Pauling) es de 1.9 Pauling. En cambio, la del enlace iónico entre el oxígeno (3.5 Pauling) y el magnesio (1.2 Pauling) es de 2.3 Pauling. Al respecto, se pueden plantear las siguientes reglas:

A lo largo de esta experiencia de aprendizaje conociste la generación de enlaces químicos, los tipos y características que poseen, las particularidades que tienen las sustancias a partir de la unión de sus átomos, así como su estabilización por medio de dichos enlaces. Es muy importante que conozcas bien las especificidades de los distintos enlaces químicos, ya que así comprenderás las formas y cualidades de las sustancias que nos rodean; esto es fundamental para el desarrollo de materiales nuevos y más resistentes que ayuden en la vida diaria.

Asegúrate de:

